
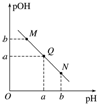
| A. | M點所示溶液的導電能力強于Q點 | |
| B. | N點所示溶液中c(CH3COO-)>c(Na+) | |
| C. | Q點水的電離程度在MN直線上最大 | |
| D. | Q點消耗NaOH溶液的體積小于醋酸溶液的體積 |
分析 酸溶液中pOH越大,說明溶液中氫氧根離子濃度越小,溶液氫離子濃度越大,酸性越強,隨著NaOH的加入,發生中和反應,溶液氫氧根離子的濃度逐漸增大,則溶液pOH逐漸減小,pH逐漸增大,結合弱電解質的電離解答該題.
解答 解:A.M點主要是醋酸,Q點主要是醋酸鈉,由于醋酸是弱酸,電離程度很小,離子濃度也較小,所以M點所示溶液的導電能力弱于Q點,故A錯誤;
B.N點所示溶液為堿性,則c(OH-)>c(H+),根據溶液電荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),可判斷出此時c(Na+)>c(CH3COO-),故B錯誤;
C.氫離子或氫氧根離子均能抑制水的電離,氫離子或氫氧根離子濃度越大對水的電離程度越大,當醋酸與氫氧化鈉恰好反應生成醋酸鈉時,水的電離程度最大,此時溶液顯堿性,故C錯誤;
D.Q點的pOH=pH,溶液為中性,而兩者等體積混合后生成醋酸鈉,水解顯堿性.則所加NaOH溶液體積略小于醋酸溶液的體積,故D正確.
故選D.
點評 本題考查酸堿中和的定性判斷和計算,側重于弱電解質的電離的考查,注意弱電解質的電離特點,把握pOH的含義,題目難度中等,側重于考查學生對基礎知識的應用能力.


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:多選題
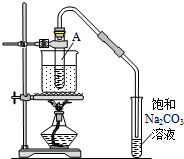 按如圖所示裝置,在試管A里加入3mL乙醇和2mL冰醋酸,然后一邊搖動,一邊慢慢地加入2mL濃硫酸,再加入少量碎瓷片,用酒精燈加熱10min,結果在飽和碳酸鈉溶液的液面上沒有無色油狀液體,下列對其原因的分析錯誤的是( )
按如圖所示裝置,在試管A里加入3mL乙醇和2mL冰醋酸,然后一邊搖動,一邊慢慢地加入2mL濃硫酸,再加入少量碎瓷片,用酒精燈加熱10min,結果在飽和碳酸鈉溶液的液面上沒有無色油狀液體,下列對其原因的分析錯誤的是( )| A. | 試管A中沒有發生反應 | |
| B. | 熱源小、水量多,水浴升溫速度太慢 | |
| C. | 產物蒸汽在試管A上部全部被冷凝回流 | |
| D. | 產物已全部溶解在飽和Na2CO3溶液中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 酸 | 電離方程式 | 電離常數 K/mol•L-1 |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.26×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=12的Ba(OH)2 | B. | pH=12的NH3•H2O | ||
| C. | 0.05 mol/L的NaOH | D. | 0.05 mol/L的BaCl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
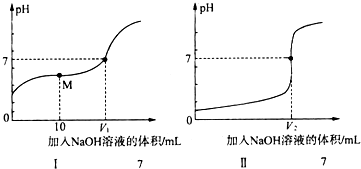
| 操作步驟 | 現象 |
| 步驟1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反應后過濾 | 出現白色沉淀 |
| 步驟2:向濾液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液變紅色 |
| 步驟3:向步驟2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 現象a |
| 步驟4:取步驟1所得少量濾渣加入到適量的3mol•L-1KI溶液中 | 出現黃色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
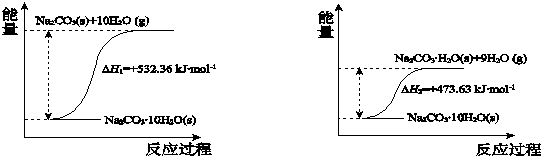
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
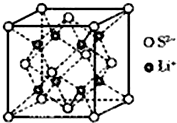 硫的單質及其化合物在工農業生產中的用途非常廣泛.回答下列問題:
硫的單質及其化合物在工農業生產中的用途非常廣泛.回答下列問題: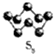 )易溶于CS2,固態時屬于分子晶體,其中硫原子雜化軌道類型為sp3.
)易溶于CS2,固態時屬于分子晶體,其中硫原子雜化軌道類型為sp3.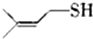 ).
).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com