
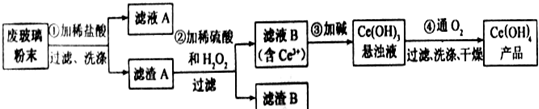
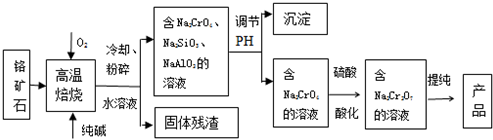
分析 ①CeO2、SiO2、Fe2O3等中加入稀鹽酸,Fe2O3轉化FeCl3存在于濾液中,濾渣為CeO2和SiO2;②加入稀硫酸和H2O2,CeO2轉化為Ce3+,濾渣為SiO2;③加入堿后Ce3+轉化為沉淀,④通入氧氣講Ce從+3氧化為+4,得到產品,
(1)根據濾渣A上含有FeCl3;取最后一次洗滌液,加入KSCN溶液,若不出現紅色,則已洗凈,反之,未洗凈;
(2)根據氧化還原反應中電子得失守恒來分析;濾渣B為SiO2;
(3)萃取劑與水不互溶,結合萃取需要的儀器分析;
(4)根據電子守恒建立關系式:Ce(OH)4~FeSO4,然后進行計算求出Ce(OH)4的質量,最后求出質量分數.
解答 解:①CeO2、SiO2、Fe2O3等中加入稀鹽酸,Fe2O3轉化FeCl3存在于濾液中,濾渣為CeO2和SiO2;②加入稀硫酸和H2O2,CeO2轉化為Ce3+,濾渣為SiO2;③加入堿后Ce3+轉化為沉淀,④通入氧氣講Ce從+3氧化為+4,得到產品,
(1)濾渣A上含有FeCl3,洗滌濾渣A的目的是為了除去Fe3+、Cl-;取最后一次洗滌液,加入KSCN溶液,若不出現紅色,則已洗凈,反之,未洗凈;
故答案為:Fe3+、Cl-;取最后一次洗滌液,加入KSCN溶液,若不出現紅色,則已洗凈,反之,未洗凈或取最后洗滌液少量,滴加AgNO3,如無白色沉淀,則洗干凈;
(2)稀硫酸、H2O2,CeO2三者反應生成轉化為Ce2(SO4)3、O2和H2O,反應的離子方程式為:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;加入稀硫酸和H2O2,CeO2轉化為Ce3+,SiO2不反應,濾渣B的成分為SiO2,
故答案為:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;SiO2;
(3)化合物TBP作為萃取劑能將鈰離子從水溶液中萃取出來,所以TBP不能與水互溶,故答案為:不能;分液漏斗;
(4)用0.1000mol/LFeSO4溶液滴定至終點,鈰被還原成Ce3+,則Fe2+被氧化為Fe3+,則
Ce(OH)4~FeSO4
0.002mol 0.1000mol/L-1×0.020L
所以m(Ce(OH)4)=0.002mol×208g/mol=0.416g,
產品中Ce(OH)4的質量分數為$\frac{0.416}{0.500}×100%$=83.20%,
故答案為:83.20%.
點評 本題以工藝流程為基礎,考查化學實驗基本操作、元素及化合物知識、化學計算、氧化還原反應等相關知識,題目難度中等,明確實驗流程及反應原理為解答關鍵,試題有利于培養學生的分析、理解能力及化學實驗、化學計算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| 研究目的 | 溫度(T) 對反應的影響 | 壓強(p)對平衡常數的影響 | 壓強(p)對反應的影響(p2>p1) | 溫度(T)對反應的影響(T1>T2) |
| 圖示 | 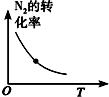 | 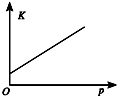 | 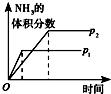 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含等物質的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| C. | 加水稀釋CH3COONa溶液,溶液中$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$的值變小 | |
| D. | 25℃時,pH=4的鹽酸與pH=4的醋酸溶液等體積混合后pH=4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
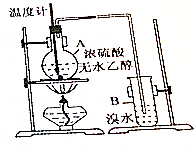 已知乙醇與濃硫酸加熱到170℃時可生成乙烯:
已知乙醇與濃硫酸加熱到170℃時可生成乙烯:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
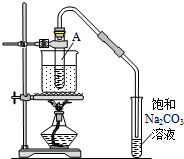 按如圖所示裝置,在試管A里加入3mL乙醇和2mL冰醋酸,然后一邊搖動,一邊慢慢地加入2mL濃硫酸,再加入少量碎瓷片,用酒精燈加熱10min,結果在飽和碳酸鈉溶液的液面上沒有無色油狀液體,下列對其原因的分析錯誤的是( )
按如圖所示裝置,在試管A里加入3mL乙醇和2mL冰醋酸,然后一邊搖動,一邊慢慢地加入2mL濃硫酸,再加入少量碎瓷片,用酒精燈加熱10min,結果在飽和碳酸鈉溶液的液面上沒有無色油狀液體,下列對其原因的分析錯誤的是( )| A. | 試管A中沒有發生反應 | |
| B. | 熱源小、水量多,水浴升溫速度太慢 | |
| C. | 產物蒸汽在試管A上部全部被冷凝回流 | |
| D. | 產物已全部溶解在飽和Na2CO3溶液中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
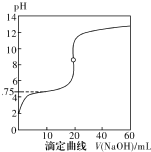 25℃時,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲線如右圖所示.下列說法正確的是( )
25℃時,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲線如右圖所示.下列說法正確的是( )| A. | 當滴人40mLNaOH溶液時,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| B. | 當溶液中c(H+)+c(OH-)=2×10-7時:c(Na+)>c(A-)>c(OH-)=c(H+) | |
| C. | 當滴人NaOH溶液20mL時c(OH-)>c(H+)+c(HA) | |
| D. | 當滴定到pH=4.75時,c(A-)=c(HA) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | pH=2的HA溶液與pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | B氨水和鹽酸混合后溶液呈酸性,溶液中可能存在:c(NH4+)>c(Cl-) | |
| C. | 在一定溫度下,相同pH的硫酸和硫酸鐵溶液中水電離出來的c(H+)分別是1.0×0×10-amol/L和是1.0×10-bmol/L,在此溫度時,水的離子積為1.0×10-(a+b) | |
| D. | 常溫下,0.1mol/L酸HA pH=3,0.1mol/L 堿BOH pH=13,則鹽BA溶液的pH<7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 操作步驟 | 現象 |
| 步驟1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反應后過濾 | 出現白色沉淀 |
| 步驟2:向濾液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液變紅色 |
| 步驟3:向步驟2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 現象a |
| 步驟4:取步驟1所得少量濾渣加入到適量的3mol•L-1KI溶液中 | 出現黃色沉淀 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com