
 某研究性學習小組對鋁熱反應實驗展開研究.現行高中化學教材(必修加選修)中對“鋁熱反應”的現象有這樣的描述:“反應放出大量的熱,并發出耀眼的光芒”、“紙漏斗的下部被燒穿,有熔融物落入沙中”.查閱《化學手冊》知,Al、Al2O3、Fe、Fe2O3熔點、沸點數據如下:
某研究性學習小組對鋁熱反應實驗展開研究.現行高中化學教材(必修加選修)中對“鋁熱反應”的現象有這樣的描述:“反應放出大量的熱,并發出耀眼的光芒”、“紙漏斗的下部被燒穿,有熔融物落入沙中”.查閱《化學手冊》知,Al、Al2O3、Fe、Fe2O3熔點、沸點數據如下:| 物質 | Al | Al2O3 | Fe | Fe2O3 |
| 熔點/℃ | 660 | 2054 | 1535 | 1462 |
| 沸點/℃ | 2467 | 2980 | 2750 | - |
分析 Ⅰ.(1)鋁的熔點比鐵低,生成鐵和液態鋁一起滴落至盛有沙子的容器中形成合金;
(2)根據鋁與NaOH溶液反應的性質設計實驗方案;
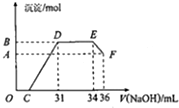
Ⅱ.(1)O→C 之間沒有沉淀生成,說明硝酸過量,O→C 之間發生的反應酸堿中和反應;根據題意熔融物與稀硝酸反應產生了硝酸銨,D與E一段沉淀的量沒有發生變化,為NH4NO3和NaOH反應;
(2)E與F之間沉淀的量減少,為Al(OH)3溶解在氫氧化鈉溶液中,利用電子守恒及發生的化學反應來計算.
解答 解:Ⅰ.(1)鋁的熔點比鐵低,生成鐵和液態鋁一起滴落至盛有沙子的容器中形成合金,所以鋁熱反應所得到的熔融物應是鐵鋁合金,
故答案為:合理;
(2)鋁與NaOH溶液反應生成氣體,反應的化學方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑,所以可用NaOH溶液檢驗所得的塊狀熔融物中含有金屬鋁,
故答案為:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
Ⅱ.(1)O→C 之間沒有沉淀生成,說明硝酸過量,O→C 之間發生的反應酸堿中和反應,離子方程式為H++OH-═H2O;根據題意熔融物與稀硝酸反應產生了硝酸銨,D與E一段沉淀的量沒有發生變化,為NH4NO3和NaOH反應,反應的離子方程式為NH4++OH-═NH3•H2O,
故答案為:H++OH-═H2O;NH4++OH-═NH3•H2O;
(2)由圖可知,EF段消耗的氫氧化鈉溶液為36mL-34m=2mL,則參加反應的氫氧化鈉為0.002L×4mol/L=0.008mol,根據Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物質的量為0.008mol,金屬混合物中含有鋁0.008mol,即為B、A的差值,
設鐵為xmol,Al為0.008mol,生成硝酸銨為:(34-31)×0.001L×4mol/L=0.012mol,由于硝酸過量,鐵反應生成了硝酸鐵,由電子守恒可知,3x+0.008×3=0.012×8,解得x=0.024mol,即反應生成氫氧化鐵的物質的量為0.024mol,生成沉淀的總物質的量為:0.008mol+0.024mol=0.032mol;滴加NaOH體積為31ml時,發生反應為①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,
則C點氫氧化鈉溶液的體積為31mL-$\frac{0.024mol×3}{4mol/L}$×1000mL-$\frac{0.008mol×3}{4mol/L}$×1000L=7mL,
故答案為:0.008;0.032;7.
點評 本題考查較為綜合,涉及鋁熱反應,金屬與硝酸的反應、離子方程式的書寫、氧化還原反應、化學計算等知識點,屬于中等難度試題;解答此題關鍵是判斷出硝酸的還原產物以及電子轉移守恒的運用.


科目:高中化學 來源: 題型:選擇題
| A. | 同系物符合同一通式 | B. | 同分異構體具有相同的分子式 | ||
| C. | 同分異構體的化學性質基本相同 | D. | 同系物的化學性質基本相似 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 0.1 mol•L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 0.1 mol•L-1 NaHCO3溶液:c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-) | |
| C. | 0.1 mol•L-1Na2S溶液:2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | pH=12的NaOH溶液與等體積pH=2的醋酸混合后的溶液:c (CH3COO-)+c (OH-)=c (Na+)+c (H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4LH2O含有的分子數為1 NA | |
| B. | 常溫常壓下,1.42g Na2SO4含有的Na+離子數為0.01 NA | |
| C. | 通常狀況下,NA個CO2分子含有原子數為3 NA | |
| D. | 物質的量濃度為0.5mol/L的MgCl2溶液中,含有Cl- 個數為1 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 橙花醛能夠發生氧化反應,不能發生還原反應 | |
| B. | 橙花醛可以使溴水褪色 | |
| C. | 橙花醛是丙烯醛是同系物 | |
| D. | 橙花醛與分子式為C10H20O的酮互為同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
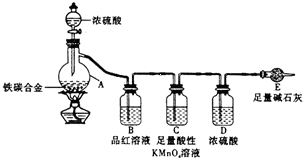 某學習小組設計了圖示實驗裝置(省略了夾持儀器)來測定某鐵碳合金中鐵的質量分數.
某學習小組設計了圖示實驗裝置(省略了夾持儀器)來測定某鐵碳合金中鐵的質量分數.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com