

分析 (1)根據方程式及燃料電池的特點判斷甲裝置;根據甲裝置判斷乙裝置;
(2)根據反應方程式得失電子判斷電極名稱;根據外加電源名稱確定乙裝置石墨電極名稱;
(3)先判斷原電池、電解池的電極名稱,再寫出相應的電極反應式;
(4)根據離子放電順序寫出相應的電解反應方程式;
(5)先根據得失電子數相等找出銀與氧氣的關系式,然后計算.
解答 解:(1)根據反應方程式知,甲裝置是一個燃料電池,所以甲是把化學能轉變為電能的裝置,是原電池;乙有外加電源,所以是電解池.
故答案為:原電池;電解池;
(2)根據2H2+O2=2H2O知,氫氣發生氧化反應,所以該電極是負極,O2 發生還原反應,所以該電極是正極;石墨與原電池的正極相連,所以石墨電極是陽極.
故答案為:負極;陽極;
(3)根據2H2+O2=2H2O知,CH3OH發生氧化反應,所以該電極是負極,O2 得電子和水反應生成氫氧根離子,發生還原反應,反應式為O2+2H2O+4e-=4OH-.
故答案為:O2+2H2O+4e-=4OH-;
(4)乙池中離子放電順序為:陽離子 Ag+>H+,陰離子OH->NO3 -,所以乙池中反應的化學方程式為4AgNO3+2H2O $\frac{\underline{\;通電\;}}{\;}$4Ag+O2↑+4HNO3,
故答案為:4AgNO3+2H2O $\frac{\underline{\;通電\;}}{\;}$4Ag+O2↑+4HNO3 ;
(5)根據得失電子數相等,H2與銀的關系式為:
H2--------2Ag
22.4L ( 2×108 )g
560mL 5.40g
故答案為560.
點評 原電池、電解池的判斷方法:
1、若無外加電源,可能是原電池,然后再根據原電池的形成條件判定.
2、若有外接電源,兩電極插入電解質溶液中,可能是電解池或電鍍池,當陽極金屬與電解質溶液中的金屬陽離子相同時,則為電鍍池.
3、若無明顯外接電源的串聯電路,則利用題中信息找出能自發進行氧化還原反應的裝置為原電池.


科目:高中化學 來源: 題型:解答題
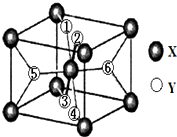 在元素周期表中,除稀有氣體外幾乎所有元素都能與氫形成氫化物.氫化物晶體的結構有共價型和離子型之分.
在元素周期表中,除稀有氣體外幾乎所有元素都能與氫形成氫化物.氫化物晶體的結構有共價型和離子型之分.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑A<B<C | |
| B. | A與C可形成離子化合物 | |
| C. | A的氧化物熔點比B的氧化物高 | |
| D. | B單質可與A的最高價氧化物發生置換反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
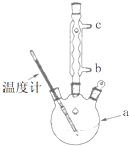 (1)阿司匹林是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,制備基本操作流程(略).
(1)阿司匹林是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,制備基本操作流程(略). .
.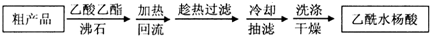
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | A | B | C | D | E | F |
| 原子半徑/nm | 0.186 | 0.143 | 0.160 | 0.102 | 0.074 | 0.099 |
| 主要化合價 | +l | +3 | +2 | +6、-2 | -2 | +7、-1 |
| A. | 元素D位于第三周期Ⅵ族 | |
| B. | A、B、C三種元素的最高價氧化物對應水化物的堿性依次增強 | |
| C. | 1mol F的單質參加氧化還原反應時轉移的電子數一定為2 mol | |
| D. | 元素B、E形成的化合物具有兩性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗操作(或設計) | 實驗現象 | 結論 | |
| A | 等體積pH=3的HA和HB兩種酸分別與足量的鋅反應,排水法收集氣體 | HA放出的氫氣多且反應速率快 | 酸性:HB>HA |
| B | 以鎂、鋁、氫氧化鈉溶液構成原電池 | 鎂表面有氣泡 | 鎂作原電池的負極 |
| C | 相同溫度下,等質量的大理石與等體積等濃度的鹽酸反應 | 粉狀大理石產生氣泡更快 | 反應速率: 粉狀大理石>塊狀大理石 |
| D | 向盛有10滴0.1mol•L-1 AgNO3溶液的試管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 NaI溶液 | 先有白色沉淀,后轉成黃色沉淀 | Ksp(AgCl )>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 一定溫度下在2L容器內進行某一反應,氣體X、氣體Y的物質的量隨反應時間變化的曲線如圖.下列敘述中正確的是( )
一定溫度下在2L容器內進行某一反應,氣體X、氣體Y的物質的量隨反應時間變化的曲線如圖.下列敘述中正確的是( )| A. | 反應的化學方程式為4X?Y | |
| B. | t2時,正反應速率等于逆反應速率 | |
| C. | t3時,Y濃度不再變化,反應達到平衡 | |
| D. | 當t1=2時,用X表示該反應在2 min內的平均反應速率為0.25mol/(L•min) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com