
分析 (1)氧化鐵和氫氧化鈉溶液不反應,鋁和氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣,根據氫氣的體積計算鋁的質量;
(2)鋁與氧化鐵在高溫下生成鐵與氧化鋁;由二者恰好反應,根據方程式可知,質量之比等于總的相對分子質量之比;
(3)由方程式可知,(2)中生成的n(Fe)等于鋁熱劑中n(Al),與鹽酸反應生成的氫氣體積之比等于金屬提供的電子的物質的量之比.注意鐵與鹽酸反應生成氯化亞鐵.
解答 (1)氧化鐵和氫氧化鈉溶液不反應,鋁和氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣,反應方程式為:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根據方程式知,鋁的質量=$\frac{bL}{22.4L/mol}$×27g/mol=$\frac{9b}{11.2}$g,
故答案為:$\frac{9b}{11.2}$;
(2)鋁與氧化鐵在高溫下生成鐵與氧化鋁,反應方程式為:2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$2Fe+Al2O3;由二者恰好反應,根據方程式可知,
質量之比等于總的相對分子質量之比,則樣品中氧化鐵與鋁的質量比為(56×2+16×3):2×27=80:27,
故答案為:2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$2Fe+Al2O3,80:27;
(3)由方程式2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$2Fe+Al2O3可知,(2)中生成的n(Fe)等于鋁熱劑中n(Al),與鹽酸反應生成的氫氣體積之比等于金屬提供的電子的物質的量之比,所以(3)中生成的氫氣與(1)中生成氫氣體積之比c:b=2n(Fe):3n(Al)=2:3,
故答案為:2:3.
點評 本題考查鋁熱反應原理及混合物反應的計算,題目難度中等,明確鋁熱反應原理為解答關鍵,注意鐵與稀鹽酸反應生成的是亞鐵離子,為易錯點,試題培養了學生的分析能力及化學實驗、化學計算能力.


 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鈣原子的結構示意圖: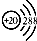 | |
| B. | 結構簡式為CH2CH2的分子可發生加成反應 | |
| C. | 符號為${\;}_{8}^{18}$O的原子常用于文物年代的測定 | |
| D. | 電子式分別為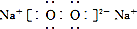 和 和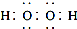 的兩種化合物均為常見的氧化劑 的兩種化合物均為常見的氧化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下pH相同的KOH溶液和K2CO3溶液中由水電離出的c(OH-) | |
| B. | 濃度均為0.1mol•L-1的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+) | |
| C. | 3 L 0.1 mol•L-1CH3COOH溶液和1L 0.3 mol•L-1CH3COOH溶液中的H+離子數 | |
| D. | 中和pH與體積均相同的NaOH溶液和氨水,所消耗H2SO4的物質的量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 干冰、鐵、氯化氫 | B. | 空氣、液氨、膽礬 | ||
| C. | 冰水混合物、燒堿、氯化鈉 | D. | 鹽酸、氧化鐵、二氧化硫 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

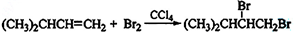 .
.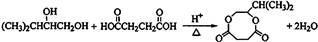 .
. .C的一氯代物只有一種(不考慮立體異構),則C的結構簡式為
.C的一氯代物只有一種(不考慮立體異構),則C的結構簡式為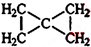 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com