
| 實驗序號 | 甲 | 乙 | 丙 |
| 合金質量/mg | 255 | 385 | 459 |
| 生成氣體體積/mL | 280 | 336 | 336 |
分析 (1)鹽酸濃、體積一定,甲中合金質量小于乙中合金質量,且甲中生成氣體體積小于乙中氣體體積,說明甲中鹽酸過量、金屬完全反應,乙中合金質量小于丙中合金質量,且乙、丙生成氣體體積相等,說明乙、丙中鹽酸完全反應,根據甲中金屬與氫氣的體積定比關系計算生成336mL氫氣需要金屬的質量,確定乙中鹽酸與金屬是否恰好反應;
(2)乙中鹽酸完全反應,鹽酸完全反應生成氫氣336mL,根據n=$\frac{V}{{V}_{m}}$計算氫氣的物質的量,根據氫元素守恒可知n(HCl)=2n(H2),據此計算;
(3)甲中鹽酸有剩余,金屬完全反應,此時生成氫氣280mL,故可以根據甲組數據計算金屬的物質的量之比,令鎂、鋁的物質的量分別為xmol、ymol,根據二者質量之和與電子轉移守恒列方程計算x、y的值,據此解答.
解答 解:(1)鹽酸濃度、體積一定,甲中合金質量小于乙中合金質量,且甲中生成氣體體積小于乙中氣體體積,說明甲中鹽酸過量、金屬完全反應,乙中合金質量小于丙中合金質量,且乙、丙生成氣體體積相等,說明乙、丙中鹽酸完全反應,生成336mL氫氣需要金屬的質量為0.255g×$\frac{336mL}{280mL}$=0.306g<0.385g,故乙中金屬剩余,鹽酸不足,
故答案為:乙,因甲反應后的溶液中再加入合金還能繼續反應,說明甲中鹽酸有剩余,若乙中鹽酸恰好完全反應,生成336mL氫氣需要金屬的質量為0.255g×$\frac{336mL}{280mL}$=0.306g<0.385g,故乙中金屬剩余;
(2)根據分析可知,乙中鹽酸不足,鹽酸完全反應生成氫氣336mL,氫氣的物質的量為$\frac{0.336L}{22.4L/mol}$=0.015mol,根據氫元素守恒可知n(HCl)=2n(H2)=2×0.015mol=0.03mol,故鹽酸的物質的量濃度為$\frac{0.03mol}{0.03L}$=1mol/L,
故答案為:1mol/L;
(3)甲中鹽酸有剩余,金屬完全反應,此時生成氫氣280mL,故可以根據甲組數據計算金屬的物質的量之比,令鎂、鋁的物質的量分別為xmol、ymol,根據二者質量可知24x+27y=0.255,根據電子轉移守恒有2x+3y=$\frac{0.28L}{22.4L/mol}$×2,聯立解得:x=0.005、y=0.005,
故合金中鎂與鋁的物質的量之比為0.005mol:0.005mol=1:1,
故答案為:1:1.
點評 本題考查了混合物反應的計算,題目難度中等,根據表中數據正確判斷過量情況為解答關鍵,注意掌握守恒思想在化學計算中的應用方法,試題培養了學生的化學計算能力.


科目:高中化學 來源: 題型:解答題
 X、Y、Z、M、Q、R是6種短周期元素,其原子半徑及主要化合價如表:
X、Y、Z、M、Q、R是6種短周期元素,其原子半徑及主要化合價如表:| 元素代號 | X | Y | Z | M | Q | R |
| 原子半徑/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合價 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分液操作時,先將分液漏斗中下層液體從下口放出,再將上層液體從下口放出 | |
| B. | 萃取操作時,可以選用CCl4或酒精作為萃取劑從溴水中萃取溴單質 | |
| C. | 蒸發操作時,應使混合物中的水分完全蒸干后,才能停止加熱 | |
| D. | 蒸餾操作時,應向蒸餾燒瓶中加入幾塊沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化鋁陶瓷和光導纖維都是無機非金屬材料 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物質 | |
| C. | 使用氫能源替代化石燃料可減少CO2排放 | |
| D. | 利用太陽能在催化劑參與下分解水制氫是把光能轉化為化學能的綠色化學方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
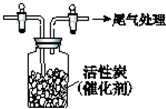 某學習小組依據SO2具有還原性,推測SO2能被Cl2氧化生成SO2Cl2.查閱資料:SO2Cl2常溫下為無色液體,極易水解,遇潮濕空氣會產生白霧.
某學習小組依據SO2具有還原性,推測SO2能被Cl2氧化生成SO2Cl2.查閱資料:SO2Cl2常溫下為無色液體,極易水解,遇潮濕空氣會產生白霧.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.05 mol | B. | 0.25 mol | C. | 0.1 mol | D. | 1 mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com