

分析 (1)由題目信息可知,氨氣與二氧化碳反應生成NH2COONH4;氨基甲酸胺易分解,圖中反應裝置用冰水冷卻,防止氨基甲酸胺分解,說明制備氨基甲酸胺的為放熱反應;
(2)根據(jù)液體石蠟瓶鼓泡瓶中氣泡控制氣體流速和原料氣體的配比;
(3)由氨基甲酸胺小晶體懸浮在四氧化碳中,可以采取過濾方法分離;
(4)氨基甲酸胺極易水解,產(chǎn)物是碳酸氫銨和一種弱堿,該弱堿為NH3•H2O;
(5)水解反應為吸熱反應,升高溫度有利于水解進行,對比6~20min內(nèi)c(NH2CCOO-)變化量越大,水解程度越大,溫度越高;
(6)生成的沉淀為碳酸鋇,根據(jù)碳原子守恒、混合物總質量列方程各自物質的量,再計算氨基甲酸胺的質量,進而計算其質量分數(shù);
(7)①活性炭具有吸附性;
②先通過陰離子交換樹脂可能生成Mg(OH)2等沉淀而影響樹脂交換效果;
③通過施加一定壓力使水分子通過半透膜而將大分子或離子截留,從而獲得純凈水的方法稱為反滲透法;
④溶液的導電能力取決于溶液中的離子濃度大小,檢驗蒸餾水的純度時,最簡單的方法是測定水的導電率.
解答 解:(1)由題目信息可知,氨氣與二氧化碳反應生成NH2COONH4,反應方程式為:2NH3(g)+CO2(g)?NH2COONH4,
氨基甲酸胺易分解,圖中反應裝置用冰水冷卻,防止氨基甲酸胺分解,說明制備氨基甲酸胺的為放熱反應,
故答案為:2NH3(g)+CO2(g)?NH2COONH4;
(2)根據(jù)液體石蠟瓶鼓泡瓶中氣泡,控制氣體流速和調(diào)節(jié)NH3與CO2通入比例,
故答案為:通過觀察氣泡,控制氣體流速和調(diào)節(jié)NH3與CO2通入比例;
(3)由氨基甲酸胺小晶體懸浮在四氧化碳中,可以采取過濾方法分離,
故答案為:過濾;
(4)氨基甲酸胺極易水解,產(chǎn)物是碳酸氫銨和一種弱堿,該弱堿為NH3•H2O,反應方程式為:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,
故答案為:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;
(5)6~20min內(nèi)曲線A中c(NH2CCOO-)減小量大于曲線B的,水解反應為吸熱反應,升高溫度有利于水解進行,故曲線A的溫度高于曲線B的,
故答案為:A;6~20min內(nèi)曲線A中c(NH2CCOO-)減小量大于曲線B的,水解反應為吸熱反應,升高溫度有利于水解進行;
(6)生成的沉淀為碳酸鋇,其物質的量為$\frac{11.82g}{197g/mol}$=0.06mol,
氨基甲酸銨物質的量為x,碳酸氫銨物質的量為y,
由碳元素守恒可知:x+y=0.06
由質量可得:78x+79y=4.69
解得x=0.05mol,y=0.01mol
故氨基甲酸銨質量為0.05mol×78g/mol=3.9g,其質量分數(shù)為$\frac{3.9g}{4.69g}$×100=83.2%,
故答案為:83.2%;
(7)①活性炭具有吸附性,則作用為吸附水中的有機物(或去除異味),
故答案為:吸附水中的有機物(或去除異味);
②A為陽離子交換樹脂,B為陰離子交換樹脂,交換后硬水中的Ca2+、Mg2+離子,易生成Mg(OH)2等沉淀而影響樹脂交換效果,不能交換,
故答案為:不能;否則硬水中的Ca2+、Mg2+離子易生成Mg(OH)2等沉淀而影響樹脂交換效果;
③通過施加一定壓力使水分子通過半透膜而將大分子或離子截留,從而獲得純凈水的方法稱為反滲透法,
故答案為:反滲透法;
④因為水的電離程度極小,所以純水是幾乎不導電的,因此要檢驗蒸餾水的純度時,最簡單易行的方法是測定水的電導率或電阻率,
故答案為:電導率(或電阻率).
點評 本題考查物質制備實驗、化學反應速率影響因素、物質含量測定、化學與技術等,屬于拼合型題目,把握反應原理為解答的關鍵,側重分析與實驗能力的考查,綜合性較強.


科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Br>Cl>P | B. | 熱穩(wěn)定性:AsH3>PH3 | ||
| C. | 堿性:CsOH>Ca(OH)2 | D. | 酸性:H3AsO4>H3PO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N2+H2→NH3 | B. | N2+O2→NO | C. | NO+O2→NO2 | D. | NO2+H2O→HNO3+NO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A.用氧化鐵作外墻涂料 | B.鑄造司母戊鼎 | C.火法煉銅 | D.淘金制飾品 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
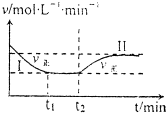 在某一恒溫恒容的密閉容器中發(fā)生如下反應:3H2(g)+N2(g)?2NH3(g)△H<O.t1時刻到達平衡后,在t2時刻改變某一條件,其反應過程如圖所示.下列說法正確的是( )
在某一恒溫恒容的密閉容器中發(fā)生如下反應:3H2(g)+N2(g)?2NH3(g)△H<O.t1時刻到達平衡后,在t2時刻改變某一條件,其反應過程如圖所示.下列說法正確的是( )| A. | Ⅰ、Ⅱ兩過程達到平衡時,平衡常數(shù):KⅠ<KⅡ | |
| B. | Ⅰ、Ⅱ兩過程達到平衡時,NH3的體積分數(shù):Ⅰ<Ⅱ | |
| C. | Ⅰ、Ⅱ兩過程達到平衡的標志:氣體密度不再發(fā)生變化 | |
| D. | t2時刻改變的條件可以是向密閉容器中加H2和N2混合氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
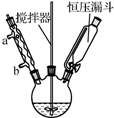 以香豆素3甲酸乙酯(
以香豆素3甲酸乙酯(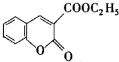 )為原料合成香豆素3甲酸(
)為原料合成香豆素3甲酸(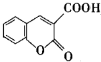 )的裝置如圖所示,實驗步驟如下:
)的裝置如圖所示,實驗步驟如下: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$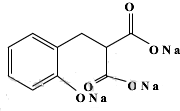 +C2H5OH+H2O.
+C2H5OH+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鈉溶液 | B. | 酚酞試液 | C. | 硝酸銀溶液 | D. | 氯化鋇溶液 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com