
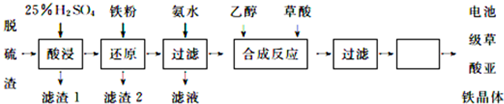
分析 脫硫渣(主要成分為 Fe2O3 )用硫酸溶解,過濾除去不溶物,濾液中主要含有硫酸鐵、硫酸等,進入鐵粉還原得到硫酸亞鐵,過濾分離,濾液中通入氨氣,得到氫氧化亞鐵沉淀,過濾分離,濾液中含有硫酸銨,氫氧化亞鐵與草酸化合得到草酸亞鐵,再經過過濾、洗滌、干燥得到草酸亞鐵晶體.
(1)硫酸鐵與Fe反應生成硫酸亞鐵,硫酸與Fe反應生成硫酸亞鐵與氫氣;
(2)TiOSO4水解能生成 H2TiO3沉淀,還生成硫酸;
(3)濾液中含有硫酸銨;
(4)過濾后,再經過洗滌、干燥得到草酸亞鐵晶體;
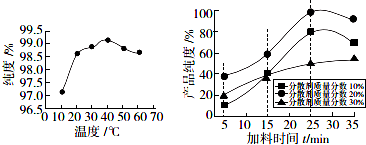
(5)應選擇純度最高時的溫度、加料時間、分散劑的質量分數;
(6)反應方程式為:10FeC2O4•2H2O+6KMnO4+24 H2SO4=5Fe2(SO4)3+20 CO2↑+6MnSO4+3K2SO4+24H2O,結合方程式計算.
解答 解:脫硫渣(主要成分為 Fe2O3 )用硫酸溶解,過濾除去不溶物,濾液中主要含有硫酸鐵、硫酸等,進入鐵粉還原得到硫酸亞鐵,過濾分離,濾液中通入氨氣,得到氫氧化亞鐵沉淀,過濾分離,濾液中含有硫酸銨,氫氧化亞鐵與草酸化合得到草酸亞鐵,再經過過濾、洗滌、干燥得到草酸亞鐵晶體.
(1)“還原”過程中反應的離子方程式還有:Fe+2Fe3+=3Fe2+,
故答案為:Fe+2Fe3+=3Fe2+;
(2)TiOSO4水解能生成 H2TiO3沉淀,還生成硫酸,反應方程式為:TiOSO4+H2O=H2TiO3↓+H2SO4,
故答案為:TiOSO4+H2O=H2TiO3↓+H2SO4;
(3)濾液中含有硫酸銨,經處理后得到一種農業上常用的化肥,
故答案為:硫酸銨;
(4)過濾后,再經過洗滌、干燥得到草酸亞鐵晶體,
故答案為:洗滌、干燥;
(5)從圖象可知,反應溫度40℃純度最高,在加料時間為 25min、分散劑的質量分數為20%,純度最佳,
故答案為:40;25;20%;
(6)配平后反應方程式為:10FeC2O4•2H2O+6KMnO4+24 H2SO4=5Fe2(SO4)3+20 CO2↑+6MnSO4+3K2SO4+24H2O,可知n(FeC2O4•2H2O)=$\frac{10}{6}$n(KMnO4)=$\frac{10}{6}$×V×10-3 L×c mol•L-1,
故m(FeC2O4•2H2O)=$\frac{10}{6}$×V×10-3 L×c mol•L-1×180g/mol=0.3cV g,
故FeC2O4•2H2O的純度為$\frac{0.3cVg}{wg}$×100%=$\frac{30cV}{w}$%,
故答案為:$\frac{30cV}{w}$.
點評 本題考查物質準備工藝流程、物質含量測定、物質的分離提純、對條件控制的選擇、氧化還原反應滴定等,需要學生具備扎實的基礎,是對學生綜合能力的考查,題目難度中等.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| NaOH溶液 | 銀氨溶液 | 新制Cu(OH)2 | 金屬鈉 | |
| A | 發生中和反應 | 不反應 | 溶解 | 生成氫氣 |
| B | 不反應 | 有銀鏡反應 | 有紅色沉淀 | 放出氫氣 |
| C | 發生水解反應 | 有銀鏡反應 | 有紅色沉淀 | 不反應 |
| D | 發生水解反應 | 不反應 | 不反應 | 不反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | H-O | O=O |
| 鍵能/KJ?mol-1 | 463.4 | 498 |
| A. | 413KJ/mol | B. | 557KJ/mol | C. | 221.6KJ/mol | D. | 436KJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
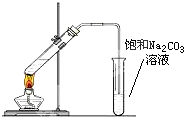 實驗室可以用圖所示的裝置制取乙酸乙酯.回答下列問題:
實驗室可以用圖所示的裝置制取乙酸乙酯.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 銅作負極 | B. | 鋅作正極 | ||
| C. | 電子由銅經導線流向鋅 | D. | 鋅片上的反應為:Zn-2e-=Zn2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com