
分析 (1)利用蓋斯定律,1式加2式的二倍即可得到該方程式及焓變;
(2)根據反應速率v=$\frac{△c}{△t}$,結合物質表示的反應速率之比等于物質前邊的系數之比來計算;
(3)平衡標志是正逆反應速率相同,各成分濃度保持不變分析判斷選項;
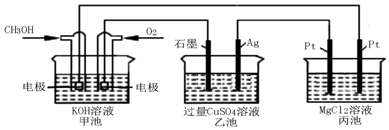
(4)堿性條件下,甲醇在負極被氧化生成碳酸根離子;
(5)圖2中甲池為原電池,通入甲醇的電極為負極,銅氧氣的電極為正極,則乙池中石墨為陽極,銀為陰極,溶液中銅離子在銀電極析出,丙中與銀連接的Pt電極為陽極,另一個電極為陰極,丙中與銀連接的Pt電極為陽極,另一個電極為陰極,電極反應為陽極:2Cl--2e-=Cl2↑,陰極為2H++2e-=H2↑,MgCl2+2H2O$\frac{\underline{\;電解\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑,甲池中發(fā)生的反應為:2CH3OH+3O2+4KOH=2K2CO3+6H2O,溶液中甲醇和氧氣反應后導致溶液質量增大,每反應2mol甲醇和3mol氧氣反應溶液質量增加=2mol×32g/mol+3mol×32g/mol=160g,電子轉移為12mol,當甲池中增重16g時,電子轉移1.2mol,電子守恒得到丙池中理論上產生沉淀為氫氧化鎂質量.
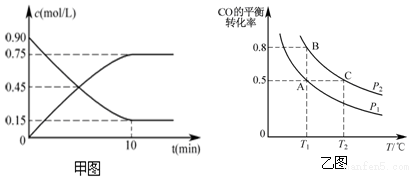
解答 解:(1)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,
故答案為:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b) kJ/mol;
(2)用甲醇表示的反應速率v=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),氫氣表示的反應速率是甲醇的2倍,即0.15mol/(L•min),
故答案為:0.15 mol/(L•min);
(3)A.H2的消耗速率等于CH3OH的生成速率的2倍,不能說明正逆反應速率相等,不一定平衡,故A錯誤;
B.H2的體積分數不再改變是化學平衡的特征,達到了平衡,故B正確;
C.反應的方程式為CO(g)+2H2(g)=CH3OH(g),充入10mol CO和20mol H2,消耗的反應物的物質的量為1:2,則無論是否達到平衡狀態(tài),H2的轉化率和CO的轉化率都相等,故C錯誤;
D.體系中氣體的平均摩爾質量等于質量和物質的量的比值,物質的量變化,質量不變,所以當體系中氣體的平均摩爾質量不再改變,證明達到了平衡,故D正確.
故答案為:BD;
(4)堿性條件下,甲醇在負極被氧化生成碳酸根離子,電極方程式為CH3OH-6e-+8OH-=CO32-+6H2O,故答案為:CH3OH-6e-+8OH-=CO32-+6H2O;
(5)圖2中甲池為原電池,通入甲醇的電極為負極,銅氧氣的電極為正極,則乙池中石墨為陽極,銀為陰極,溶液中銅離子在銀電極析出,Cu2++2e-=Cu,陽極上是氫氧根離子放電生成氧氣,所以電極反應為:4OH--4e-=2H2O+O2↑,電池反應的離子方程式為:2Cu2++2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2+4H+,丙中與銀連接的Pt電極為陽極,另一個電極為陰極,電極反應為陽極:2Cl--2e-=Cl2↑,陰極為2H++2e-=H2↑,MgCl2+2H2O$\frac{\underline{\;電解\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑,甲池中發(fā)生的反應為:2CH3OH+3O2+4KOH=2K2CO3+6H2O,溶液中甲醇和氧氣反應后導致溶液質量增大,每反應2mol甲醇和3mol氧氣反應溶液質量增加=2mol×32g/mol+3mol×32g/mol=160g,電子轉移為12mol,當甲池中增重16g時,電子轉移1.2mol,電子守恒得到丙池中理論上產生沉淀為氫氧化鎂,依據化學方程式,生成1mol氫氧化鎂,電子轉移2mol電子,則電子轉移1.2mol,生成沉淀氫氧化鎂0.6mol,計算得到物質的量為質量=0.6mol×58g/mol=34.8g,
故答案為:2Cu2++2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2+4H+;34.8.
點評 本題考查了化學平衡的計算、化學平衡狀態(tài)的判斷、化學平衡的影響因素、電解池和原電池原理的計算等知識,題目難度中等,明確影響化學反應速率的因素為解答關鍵,試題側重考查學生的分析能力及化學計算能力.


 陽光課堂同步練習系列答案
陽光課堂同步練習系列答案科目:高中化學 來源: 題型:選擇題
| 所含離子 | NO3- | SO42- | H+ | M |
| 濃度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | H+ | D. | S2- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 中國是世界上第一鋼鐵生產大國,近兩年鋼鐵行業(yè)形式急轉直下,不少鋼鐵企業(yè)陷入全面虧損,2015年,鋼鐵年產量出現34年來的首次下降.原因就是因為高爐煉鐵技術低級落后,不能生產高附加值產品.請根據所學知識回答下列問題:
中國是世界上第一鋼鐵生產大國,近兩年鋼鐵行業(yè)形式急轉直下,不少鋼鐵企業(yè)陷入全面虧損,2015年,鋼鐵年產量出現34年來的首次下降.原因就是因為高爐煉鐵技術低級落后,不能生產高附加值產品.請根據所學知識回答下列問題:| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 綜合利用CO2、CO對構建低碳社會有重要意義.
綜合利用CO2、CO對構建低碳社會有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用浸泡過高錳酸鉀溶液的硅藻土保鮮水果 | |
| B. | 用熱堿水清除炊具上殘留的油污 | |
| C. | 用活性炭去除冰箱中的異味 | |
| D. | 用含硅膠、鐵粉的透氣小袋與食品一起密封包裝 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K越大,反應程度越大 | B. | K越大,反應程度越小 | ||
| C. | K的大小與反應程度無關 | D. | 升高溫度,K增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖是硫酸試劑瓶標簽上的內容:
如圖是硫酸試劑瓶標簽上的內容:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com