
| 化學鍵 | P-P | P-O | O=O | P=O |
| 鍵能/kJ•mol-1 | 197 | 360 | 499 | X |
分析 (1)溫度越高,反應速率越快;
(2)為使濾液中的Fe2+完全被H2O2氧化,加入的氧化劑要過量,且使反應物充分反應;
(3)氫氧根離子和鐵離子反應生成紅褐色沉淀氫氧化鐵;
(4)白磷燃燒的方程式為P4+5O2=P4O10,根據化學鍵的斷裂和形成的數目進行計算;
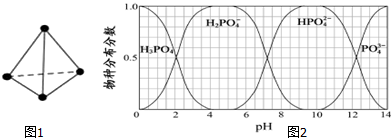
(5)根據為獲得盡可能純的NaH2PO4,pH應控制從圖表中找出H2PO4-分布分數最大值所在區間;溶液中主要含磷物種濃度大小關系可由圖表得出.
解答 解:(1)溫度越高,反應速率越快,所以反應加熱的目的是加快鐵與稀硫酸反應速率,
故答案為:加快Fe和稀硫酸的反應速率;
(2)A、加熱,使反應在較高溫度下進行,雖然反應速率加快,但能促進亞鐵離子水解而產生雜質,故錯誤;
B、用氨水調節溶液pH=7,亞鐵離子和氫氧根離子反應生成氫氧化亞鐵雜質,故錯誤;
C、加入適當過量的H2O2溶液,導致鐵離子能完全反應,故正確;
D、緩慢滴加H2O2溶液并攪拌,反應物接觸面積增大,能使鐵離子完全反應,故正確;
故選CD;
(3)堿性條件下,溶液中含有大量氫氧根離子,氫氧根離子和鐵離子反應生成紅褐色沉淀氫氧化鐵,導致反應得到的FePO4•H2O固體呈棕黃色,
故答案為:Fe(OH)3;
(4)已知白磷固體(P4 結構如圖1所示)的燃燒熱為.2378.0kJ/mol,反應的熱化學方程式為:P4(s)+5O2(g)=P4O10 (s)△H=-2378.0 kJ/mol,白磷燃燒的方程式為P4+5O2=P4O10,1mol白磷完全燃燒需拆開6mol P-P、5mol O=O,形成12molP-O、4mol P=O,所以12mol×360kJ/mol+4mol×xkJ/mol-(6mol×197 kJ/mol+5 mol×499 kJ/mol)=2378.0kJ,x=433.75≈434.
故答案為:-2378.0;434;
(5)為獲得盡可能純的NaH2PO4,pH應控制從圖表中找出H2PO4-分布分數最大值所在區間,即4~5.5(介于此區間內的任意值或區間均可),溶液中主要含磷物種濃:度大小關系可由圖表得出 c(HPO42-)>c(H2PO4-),
故答案為:4~5.5(介于此區間內的任意值或區間均可);c(HPO42-)>c(H2PO4-).
點評 本題以鐵及其化合物為載體考查了物質的制備,涉及氧化還原反應、實驗操作、反應速率的影響因素等知識點,根據物質之間的關系式、實驗操作的規范性、影響反應速率的因素等知識點來分析解答,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. 的沸點高.(填高或低)
的沸點高.(填高或低)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.0176 | B. | 0.1600 | C. | 0.1200 | D. | 0.2400 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 NH4Al(SO4)2是食品加工中最為快捷的食品添加劑,用于焙烤食品中;NH4HSO4在分析試劑、醫藥、電子工業中用途廣泛.請回答下列問題:
NH4Al(SO4)2是食品加工中最為快捷的食品添加劑,用于焙烤食品中;NH4HSO4在分析試劑、醫藥、電子工業中用途廣泛.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ④②①③ | B. | ①④③② | C. | ②③①④ | D. | ②④①③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 結合下表回答下列問題(均為25℃時的數據)
結合下表回答下列問題(均為25℃時的數據)| 酸 | 電離平衡常數(Ka) | 酸 | 電離平衡常數(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com