

 .
. 的沸點高.(填高或低)
的沸點高.(填高或低)分析 (一)由核外電子排布式可知,A為Li、B為O、C為Ne、D為Si、E為Cu;
(1)稀有氣體的第一電離能最大;
(2)Cu屬于過渡元素;
(3)非金屬性越強,電負性越大;
(4)元素之間能形成X2Y型化合物為Li2O、Cu2O;
(二)(1)A元素基態原子的最外層有3個未成對電子,次外層有2個電子,該元素為N元素;
(2)D元素的正三價離子的3d能級為半充滿,基態原子外圍電子排布為3d64s2;
(3)E元素基態原子的M層全充滿,N層沒有成對電子,只有一個未成對電子,基態原子外圍電子排布為3d604s1,則E為Cu,為面心立方密堆積;
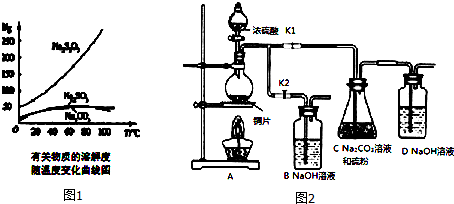
(三)在給出的元素中,c、d均是熱和電的良導體,二者為金屬,再結合圖一,d的熔點比c的高,可知d為Cu,c為Na,由單質的熔點高低的順序可知a為氫氣,b為氮氣,e為Si,f為碳單質.
(1)a、f對應的元素以原子個數比1:1形成的分子為乙炔;
(2)a與b的元素形成的10電子中性分子X為NH3,將NH3溶于水后的溶液滴入到AgNO3溶液中至過量,得到配離子[Ag(NH3)2]+;
(3)分子間氫鍵增大物質熔沸點,而分子內氫鍵降低物質熔沸點;
(4)根據圖二可知該酸為HNO3,與水分子之間形成氫鍵,結合相似相溶分析解答.
解答 解:(一)由核外電子排布式可知,A為Li、B為O、C為Ne、D為Si、E為Cu;
(1)稀有氣體Ne的第一電離能最大,故答案為:Ne;
(2)Cu屬于過渡元素,故答案為:Cu;
(3)上述元素中O元素非金屬性最強,故O元素電負性最大,故答案為:O;
(4)元素之間能形成X2Y型化合物為Li2O、Cu2O,故答案為:Li2O、Cu2O;
(二)(1)A元素基態原子的最外層有3個未成對電子,次外層有2個電子,該元素為N元素,故答案為:N;
(2)D元素的正三價離子的3d能級為半充滿,基態原子外圍電子排布為3d64s2,D為Fe,價電子排布圖為,
故答案為:Fe; ;
;
(3)E元素基態原子的M層全充滿,N層沒有成對電子,只有一個未成對電子,基態原子外圍電子排布為3d604s1,則E為Cu,為面心立方最密堆積,空間利用率為74%,
故答案為:面心立方最密;74%;
(三)在給出的元素中,c、d均是熱和電的良導體,二者為金屬,再結合圖一,d的熔點比c的高,可知d為Cu,c為Na,由單質的熔點高低的順序可知a為氫氣,b為氮氣,e為Si,f為碳單質.
(1)a、f對應的元素以原子個數比1:1形成的分子為乙炔,乙炔分子中含有2個C-H鍵和1個-C≡C-,C-H鍵為δ鍵,-C≡C-中有1個δ鍵,2個π鍵,所以乙炔分子含有3個δ鍵,2個π鍵,
故答案為:3; 2;
(2)a與b的元素形成的10電子中性分子X為NH3,空間構型為三角錐型.氨氣與AgNO3溶液生成[Ag(NH3)2]+.Ag+提供空軌道,氨氣分子提供孤對對子,通過配位鍵形成[Ag(NH3)2]+,
故答案為:三角錐形;[Ag(NH3)2]+,配位;
(3)前者形成分子間氫鍵,增大物質熔沸點,而后者分子內氫鍵,降低物質熔沸點,故前者熔沸點更高,故答案為:高;
(4)根據圖二可知該酸為HNO3,HNO3是極性分子,易溶于極性溶劑水中,HNO3分子中的-OH易與水分子之間形成氫鍵,
故答案為:HNO3是極性分子,易溶于極性溶劑水中,HNO3分子中的-OH易與水分子之間形成氫鍵.
點評 本題是對物質結構與性質的考查,需要學生熟練掌握基礎知識并靈活應用,難度中等.


 能力評價系列答案
能力評價系列答案 唐印文化課時測評系列答案
唐印文化課時測評系列答案 導學與測試系列答案
導學與測試系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl | B. | NaOH | C. | AgNO3 | D. | BaCl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
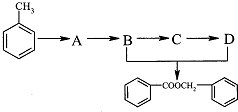
| 編號 | 1 | 2 | 3 | 4 |
| 溶液的體積/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2標準溶液的體積/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 3:2 | B. | 4:3 | C. | 4:1 | D. | 2:l |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
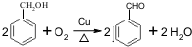
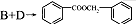 的化學方程式為
的化學方程式為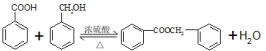
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | P-P | P-O | O=O | P=O |
| 鍵能/kJ•mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com