
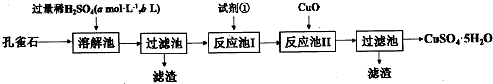
分析 孔雀石的主要成分為Cu2(OH)2CO3,還含少量Fe0、Si02,加入稀硫酸反應后生成二氧化碳氣體,得到溶液硫酸銅溶液、硫酸亞鐵液,為了提高反應速率,提高溶解率,可以將孔雀石要粉碎,過濾得到二氧化硅固體,濾液中加入氧化劑將Fe2+氧化成Fe3+,為了不引入新的雜質,最好用雙氧水氧化,再加入CuO固體調節溶液pH沉淀鐵離子過濾得到濾液為硫酸銅溶液,通過蒸發濃縮,冷卻結晶,過濾洗滌得到硫酸銅晶體,據此答題.
解答 解:孔雀石的主要成分為Cu2(OH)2CO3,還含少量Fe0、Si02,加入稀硫酸反應后生成二氧化碳氣體,得到溶液硫酸銅溶液、硫酸亞鐵液,為了提高反應速率,提高溶解率,可以將孔雀石要粉碎,過濾得到二氧化硅固體,濾液中加入氧化劑將Fe2+氧化成Fe3+,為了不引入新的雜質,最好用雙氧水氧化,再加入CuO固體調節溶液pH沉淀鐵離子過濾得到濾液為硫酸銅溶液,通過蒸發濃縮,冷卻結晶,過濾洗滌得到硫酸銅晶體,
(1)根據上面的分析可知,孔雀石首先要粉碎,其目的是加快溶解速率,提高溶解率,
故答案為:加快溶解速率,提高溶解率;
(2)從CuS04溶液中獲取CuS04•5H20所進行的操作是加熱、蒸發濃縮、冷卻結晶、過濾,
故答案為:冷卻結晶;
(3)根據上面的分析可知,溶解池中所發生的化學反應方程式為Cu2(OH)2C03+H2SO4=CuSO4+H2O+C02↑、FeO+H2SO4=FeSO4+H2O,
故答案為:Cu2(OH)2C03+H2SO4=CuSO4+H2O+C02↑、FeO+H2SO4=FeSO4+H2O;
(4)濾液中加入氧化劑將Fe2+氧化成Fe3+,為了不引入新的雜質,最好用雙氧水氧化,故選D,反應池I中發生反應的離子方程式為2Fe2++2H++H2O2=2Fe3++2H2O,
故答案為:D;2Fe2++2H++H2O2=2Fe3++2H2O;
(5)室溫下,向反應池II中加入Cu0調pH為4,c(OH-)=10-10 mol/L,此時溶液中$\frac{c({Cu}^{2+})}{c({Fe}^{3+})}$=$\frac{\frac{Ksp[Cu(OH){\;}_{2}]}{{c}^{2}(OH{\;}^{-})}}{\frac{Ksp[Fe(OH){\;}_{3}]}{{c}^{3}(OH{\;}^{-})}}$=$\frac{\frac{2.2×1{0}^{-20}}{({1{0}^{-10})}^{2}}}{\frac{4.0×1{0}^{-38}}{(1{0}^{-10})^{3}}}$=5.5×107,
故答案為:5.5×107;
(6)含Cu2(OH)2C03質量分數為C%的孔雀石dg,則含銅元素的物質的量為$\frac{dC%}{222}$mol,所以理論上能獲取CuS04•5H20的質量為$\frac{dC%}{222}$mol×250g/mol=$\frac{250dC%}{222}$g,
故答案為:$\frac{250dC%}{222}$g.
點評 本題考查學生對實驗原理與實驗操作的理解、物質分離提純、元素化合物性質、氧化還原反應滴定、化學計算等,難度中等,清楚實驗原理是解題的關鍵,需要學生具備扎實的基礎知識與綜合運用知識分析問題、解決問題的能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 3:2 | B. | 4:3 | C. | 4:1 | D. | 2:l |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 L乙烯所含共用電子對數為5NA | |
| B. | 72g Ca02所含離子總數為3NA | |
| C. | 常溫下,將1mol Cl2通入到過量的NaOH溶液中,電子轉移數目為NA | |
| D. | 1L0.1mol/L Na2C03溶液中,C032-數目為0.lNA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | P-P | P-O | O=O | P=O |
| 鍵能/kJ•mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某無色溶液:CO32-NO3- Al3+ Ba2+ | |
| B. | 使酚酞變紅的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 加入Al能放出H2的溶液中 NH4+、Cl-、Na+、SO42- | |
| D. | 酸性溶液中:NO3-、SO32-、Na+、Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 資料卡 NO:2006-KI-001 主題:二氧化硫的還原性 ①課本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的過氧化氫溶液,振蕩片刻后滴加稀鹽酸,有白色沉淀生成 ②《無機化學》下冊,P658:亞硫酸是較強的還原劑,可以將Cl2、I2、MnO4-還原為Cl-、I-、Mn2+,如: H2SO3+I2+H2O═H2SO4+2HI |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 分別用炒鍋加熱兩種樣品,全部分解揮發,沒有物質殘留的是小蘇打 | |
| B. | 先將兩樣品配成溶液,分別加入CaCl2,無白色沉淀生成的是小蘇打 | |
| C. | 兩只小玻璃杯,分別加入少量兩種樣品,再加入等濃度等體積的食醋,產生氣泡快的是小蘇打 | |
| D. | 先將兩樣品配成溶液,分別加入澄清石灰水,無白色沉淀生成的是小蘇打 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com