
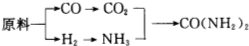
分析 (1)溫度影響化學反應速率及化學平衡;工業生產中,以氨氣為原料合成硝酸,是先將氨催化氧化生成一氧化氮,一氧化氮與氧氣反應生成二氧化氮,二氧化氮與水反應生成硝酸,據此寫化學方程式;
(2)用原料所制得的H2和CO2的物質的量之比若最接近合成尿素的原料氣NH3(換算成H2的物質的量)和CO2的物質的量之比,原料的利用率最高,根據原料氣產生的H2和CO2的物質的量之比判斷;
(3)①根據反應物和生成物,寫出反應Ⅰ的化學方程式;
②加入強還原性的對苯二酚等物質,目的是防止亞硫酸銨(NH4)2SO3被氧化;
③檢驗SO42-所用試劑是鹽酸和氯化鋇;
(4)①二氧化硫和氫氧化鈉反應生成NaHSO3;
②陽極區產生的氣體氯氣的溶液與二氧化硫發生氧化還原反應.
解答 解:(1)合成氨反應的化學方程式為:N2(g)+3H2(g)$\frac{催化劑}{高溫高壓}$2NH3(g)△H=-92.2kJ/mol,在400~500℃的高溫時,催化劑的催化活性最強,同時升高溫度雖然不利于平衡向正反應方向移動,但能增大反應速率,縮短達到平衡的時間;工業生產中,以氨氣為原料合成硝酸,是先將氨催化氧化生成一氧化氮,一氧化氮與氧氣反應生成二氧化氮,二氧化氮與水反應生成硝酸,所以工業生產硝酸的最后一步的化學方程式為3NO2+H2O=2HNO3+NO,
故答案為:催化活性最強,增加反應速率,縮短達到平衡的時間; 3NO2+H2O=2HNO3+NO;
(2)NH3(換算成H2的物質的量)和CO2的物質的量之比為2:1合成尿素,即H2和CO2的物質的量之比為$\frac{2×3}{2}$:1=3:1.
甲廠以焦炭和水為原料,C+2H2O$\frac{\underline{\;高溫\;}}{\;}$CO2+2H2,生成的H2和CO2的物質的量之比為2:1.
乙廠以天然氣和水為原料,CH4+2H2O$\frac{\underline{\;高溫\;}}{\;}$CO2+4H2,生成的H2和CO2的物質的量之比為4:1.
丙廠以石腦油和水為原料,C5H12+10H2O$\frac{\underline{\;高溫\;}}{\;}$5CO2+16H2,生成的H2和CO2的物質的量之比為16:5,丙最接近3:1,
故答案為:丙;
(3)①根據反應物和生成物,寫出反應Ⅰ的化學方程式為:2CaCO3+O2+2SO2=2CaSO4+2CO2,
故答案為;2CaCO3+O2+2SO2=2CaSO4+2CO2;
②亞硫酸根離子易被氧化,向反應Ⅱ的溶液中加入強還原性的對苯二酚等物質,目的是防止亞硫酸銨(NH4)2SO3被氧化,
故答案為:防止亞硫酸銨(NH4)2SO3被氧化;
③檢驗SO42-所用試劑是鹽酸和氯化鋇(HCl 和 BaCl2),
故答案為:鹽酸和氯化鋇(HCl 和 BaCl2);
(4)①二氧化硫和氫氧化鈉反應生成NaHSO3,SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O),
故答案為:SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O);
②陽極區產生的氣體氯氣的溶液與二氧化硫發生氧化還原反應,SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案為:SO2+Cl2+2H2O=4H++SO42-+2Cl-.
點評 本題考查了影響化學反應速率的因素,化學方程式的計算,離子反應等,考查的知識點較多,結合性強,題目難度中等,試題能夠提高學生的分析、理解能力及計算能力.


科目:高中化學 來源: 題型:多選題
| A. | 鍋爐中沉積的CaSO4可用Na2CO3溶液浸泡后,再將不溶物用稀鹽酸溶解去除 | |
| B. | 常溫下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的電離程度前者比后者大 | |
| C. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室溫下不能自發進行,說明該反應的△H<0 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀釋后,c(OH-)、CH3COOH的電離程度均增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
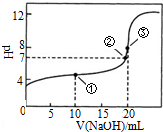 常溫下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲線如圖.下說法正確的是( )
常溫下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲線如圖.下說法正確的是( )| A. | 滴定過程中可能出現:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 點①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| C. | 點③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 點③所示溶液中:c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHCO3水解:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用石墨作電極電解氯化鎂溶液:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 乙醛與新制的Cu(OH)2懸濁液加熱:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 向Ba(OH)2溶液中加入過量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E五種常見元素的核電荷數依次增大.A的基態原子中有2個未成對電子,B是地殼中含量最多的元素,C是短周期中最活潑的金屬元素,D與C可形成CD型離子化合物,E的基態3d軌道上有2個電子.請回答下列問題:
A、B、C、D、E五種常見元素的核電荷數依次增大.A的基態原子中有2個未成對電子,B是地殼中含量最多的元素,C是短周期中最活潑的金屬元素,D與C可形成CD型離子化合物,E的基態3d軌道上有2個電子.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 檢驗淀粉是否發生水解,將淀粉與稀硫酸溶液共熱,冷卻后,取上層水溶液,用NaOH中和稀硫酸后,再加入Cu(OH)2懸濁液,加熱,觀察是否產生磚紅色沉淀 | |
| B. | 檢驗Fe(NO3)2晶體是否已氧化變質,將Fe(NO3)2樣品溶于稀硫酸后,滴加KSCN溶液,觀察溶液是否變血紅色 | |
| C. | 在酸、堿中和滴定終點時不慎滴入過量標準溶液,可用裝有待測液的滴定管再滴入一定量溶液進行調整 | |
| D. | 實驗室制備氫氧化亞鐵,滴加氫氧化鈉溶液時應將膠頭滴管插入硫酸亞鐵溶液中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com