
| 序號 | 反應物 | 產物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | KClO3、濃鹽酸 | Cl2、… |
| A. | 第①組反應的其余產物為H2O和O2 | |
| B. | 第②組反應中Cl2與FeBr2的物質的量之比為1:2 | |
| C. | 第③組反應中還原產物是KCl,生成3 mol Cl2轉移電子6mol | |
| D. | 氧化性由強到弱順序為ClO3->Cl2>Br2>Fe3+ |
分析 A.反應中KMnO4→MnSO4,Mn元素化合價由+7價降低為+2價,根據電子轉移守恒,H2O2中氧元素化合價升高,應生成氧氣,根據元素守恒還生成水;
B.由元素化合價可知,反應中只有亞鐵離子被氧化,結合電子轉移守恒計算;
C.由信息可知,Cl元素化合價由-1價升高為0價,計算轉移電子;
D.氧化劑氧化性強于氧化產物氧化性,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+.
解答 解:A.反應中KMnO4→MnSO4,Mn元素化合價由+7價降低為+2價,根據電子轉移守恒,H2O2中氧元素化合價升高,生成氧氣,根據H元素守恒可知還生成水,故A正確;
B.由元素化合價可知,反應中只有亞鐵離子被氧化,根據電子轉移守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,故B正確;
C.由信息可知,Cl元素化合價由-1價升高為0價,生成3mo1C12,只有5molCl得到電子,轉移電子為5mo1,故C錯誤;
D.氧化劑氧化性強于氧化產物氧化性,由③可知氧化性ClO3->Cl2,由②可知氧化性Cl2>Br2,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,故D正確;
故選C.
點評 本題考查氧化還原反應,為高頻考點,把握元素的化合價變化、基本概念為解答的關鍵,側重分析與應用能力的考查,注意氧化的先后及電子守恒應用,題目難度不大.


 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在氧化還原反應中,還原劑一定是失去電子的反應物 | |
| B. | 在氧化還原反應中,非金屬單質一定是氧化劑 | |
| C. | 某元素從化合態轉變為游離態時,該元素一定被還原 | |
| D. | 金屬陽離子被還原不一定得到金屬單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 弱酸 | 電離平衡常數(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
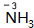 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com