

| A. | 海水淡化前需進行預處理,通常用明礬[K2SO4•Al2(SO4)3•24H2O]作混凝劑,降低濁度,明礬水解的離子方程式是:Al3++3H2O?Al(OH)3+3H+ | |
| B. | 裝置中由NaCl轉化為NaClO的化學方程式是:NaCl+H2O═H2↑+NaClO | |
| C. | 海水中含有Ca2+、Mg2+、HCO3-等雜質離子,處理過程中裝置的陰極易產生水垢,其主要成分是Mg(OH)2和CaCO3 | |
| D. | 若每隔5-10 min倒換一次電極電性,可有效地解決陰極的結垢問題 |
分析 A、鋁離子水解生成氫氧化鋁膠體,膠體具有吸附懸浮雜質的作用可以凈水
B、電解飽和氯化鈉溶液反應生成氫氧化鈉、氯氣和氫氣,氯氣和氫氧化鈉溶液反應生成氯化鈉、次氯酸鈉和水;
C、陰極生成氫氣,水的電離被破壞電極附近生成氫氧化鈉,氫氧化鈉和碳酸氫鈣,碳酸氫鎂反應生成氫氧化鎂、碳酸鈣沉淀;
D、陰極結垢后倒換電極電性,陰極變為陽極,其電極反應為:2Cl--2e-=Cl2↑,產生的氯氣與水發生反應:Cl2+H2O=HCl+HClO,酸溶解沉淀.
解答 解:A、鋁離子水解生成氫氧化鋁膠體,膠體具有吸附懸浮雜質的作用可以凈水,反應的離子方程式為:Al3++3H2O?Al(OH)3+3H+,故A正確;
B、裝置中由NaCl轉化為NaClO的化學方程式是2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O,故B錯誤;
C、陰極生成氫氣,電極附近水的電離被破壞,電極附近生成氫氧化鈉,氫氧化鈉和碳酸氫鈣,碳酸氫鎂反應生成氫氧化鎂、碳酸鈣沉淀,氫氧化鈉和碳酸氫鈣反應生成CaCO3的沉淀產生水垢,生成碳酸鈣沉淀的反應離子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O,處理過程中裝置的陰極易產生水垢,其主要成分是Mg(OH)2和CaCO3,故C正確;
D、由電解原理可知,陰極結垢后倒換電極電性,陰極變為陽極,其電極反應為:2Cl--2e-=Cl2↑,產生的氯氣與水發生反應:Cl2+H2O=HCl+HClO,使該電極附近溶液呈酸性,從而將Mg(OH)2和CaCO3溶解而達到除垢的目的,故D正確;
故選B.
點評 本題考查較綜合,涉及海水資源的利用、電解原理、反應熱計算、鹽類水解等,綜合性較強,注重高頻考點的考查,把握反應原理為解答的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題

| A. | B為固體 n>1 | B. | B為液體 n>1 | C. | B為氣體 n>1 | D. | B為氣體 n<1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 2,3-二甲基戊烷
2,3-二甲基戊烷

 C5H10.
C5H10.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④⑦⑧⑨⑩ | B. | ③④⑦⑧⑨⑩ | C. | ①②③④⑥⑦⑧⑨⑩ | D. | ③④⑥⑦⑧⑨⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1molC6H6在標準狀態下的體積是2.24L | |
| B. | 含有0.1molFeCl3溶液配制成氫氧化鐵膠體,膠體分散質微粒小于0.1NA | |
| C. | 25℃時,pH=13的Ba(OH)2溶液中含有的OH-數為0.1NA | |
| D. | 1mol冰醋酸和1mol乙醇經催化加熱反應可生成H2O分子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
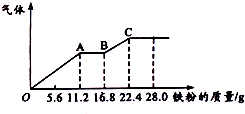 某稀硫酸和稀硝酸的混合溶液200mL,平均分成兩份,向其中一份逐漸加入銅粉,最多能溶解19.2g(已知硝酸只被還原為NO氣體),向另一份中逐漸加入鐵粉,產生氣體的最隨鐵粉質量增加的變化如圖所示,下列分析或結果錯誤的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成兩份,向其中一份逐漸加入銅粉,最多能溶解19.2g(已知硝酸只被還原為NO氣體),向另一份中逐漸加入鐵粉,產生氣體的最隨鐵粉質量增加的變化如圖所示,下列分析或結果錯誤的是( )| A. | H2SO4濃度為5mol•L-1 | |
| B. | 第二份溶液中最終溶質為FeSO4 | |
| C. | 每份混合酸中NO3-物質的量為0.2mol | |
| D. | OA段產生的是NO,AB段的反應為Fe+2Fe3+=3Fe2+,BC段產生氫氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 相對于途徑①、③,途徑②更好地體現了綠色化學思想 | |
| B. | Y可以是葡萄糖溶液 | |
| C. | CuSO4在1100℃所得混合氣體X中一定有O2 | |
| D. | 途徑①所用混酸中H2SO4與HNO3物質的量之比最好為3:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水 | B. | 濃鹽酸 | C. | 高錳酸鉀溶液 | D. | 苯 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com