
 ;水溶液PH=8,則C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精確值).
;水溶液PH=8,則C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精確值).分析 W、X、Y、Z是原子序數依次增大的同一短周期元素,W、X是金屬元素,Y、Z是非金屬元素,
(1)W、X是金屬元素,W、X各自的最高價氧化物對應的水化物可以反應生成鹽和水,則W為Na,X為Al;
(2)W與Y可形成化合物W2Y,該化合物為Na2S,硫化鈉是鈉離子和硫離子間通過離子鍵形成的離子化合物;根據物料守恒和電荷守恒計算;
(3)S的低價氧化物為二氧化硫,與NaOH溶液反應可以生成Na2SO3或NaHSO3,Na2SO3溶液顯堿性,NaHSO3溶液顯酸性;根據電荷守恒計算;
(4)常溫下,pH=10的堿NaOH和pH=4的酸H2SO3等體積混合后溶液顯酸性,說明生成NaHSO3;Na2SO3溶液顯堿性,亞硫酸根離子水解生成氫氧根離子.
解答 解:在短周期元素中,第二周期和第三周期的前面元素是金屬,后面元素是非金屬,
(1)(1)W、X是金屬元素,W、X各自的最高價氧化物對應的水化物可以反應生成鹽和水,則W為Na,X為Al,氫氧化鋁是兩性氫氧化物,能和強堿反應生成鹽和水,該反應的離子方程式為Al(OH)3+OH-=AlO2-+2H2O,
故答案為:Al(OH)3+OH-=AlO2-+2H2O;
(2)W與Y可形成化合物W2Y,則 Y是非金屬硫,硫化鈉使鈉離子和硫離子間通過離子鍵形成的離子化合物,電子式為: ;
;
Na2S溶液中存在物料守恒為c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),電荷守恒為c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),
則c(HS-)+2c(H2S)=c(OH-)-c(H+)=10-6-10-8mol/L
故答案為: ;10-6-10-8mol/L;
;10-6-10-8mol/L;
(3)S的低價氧化物為二氧化硫,與NaOH溶液反應可以生成Na2SO3或NaHSO3,Na2SO3溶液顯堿性,NaHSO3溶液顯酸性,已知溶液顯中性,說明是二者的混合物,所以溶液中溶質為Na2SO3、NaHSO3;溶液中電荷守恒為c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),已知c(H+)=c(OH-),則c(Na+)=2c(SO32-)+c(HSO3-)
故答案為:Na2SO3、NaHSO3;2c(SO32-)、c(HSO3-);
(4)常溫下,pH=10的堿NaOH和pH=4的酸H2SO3等體積混合后溶液顯酸性,已知Na2SO3溶液顯堿性,NaHSO3顯酸性,說明生成NaHSO3;Na2SO3溶液顯堿性,是因為亞硫酸根離子水解生成氫氧根離子,其水解方程式為:SO32-+H2O?HSO3-+OH-;
故答案為:NaHSO3;堿;SO32-+H2O?HSO3-+OH-.
點評 本題考查位置、結構、性質的關系,熟悉第三周期元素的性質變化規律及常見元素的單質和化合物的性質是解答本題的關鍵,題目難度中等,側重于考查學生的分析能力和對基礎知識的應用能力.


科目:高中化學 來源: 題型:解答題
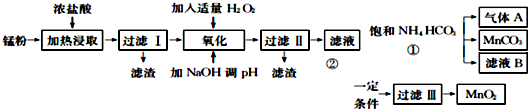
| 氫氧化物 | Fe(OH) | Fe(OH) | Mn0H)2 | Zn(OH)2 |
| 開始沉淀的pH | 7.5 | 2.2 | 8.8 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
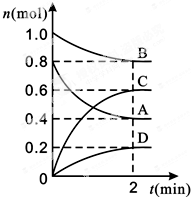 T℃時,在容積為0.5L的密閉容器中發生某一反應,且測得不同時間容器中四種物質A、B、C、D的物質的量變化如圖所示.已知:物質A、B、C均為氣態、D為固態,正反應是吸熱反應.根據要求回答下列問題:
T℃時,在容積為0.5L的密閉容器中發生某一反應,且測得不同時間容器中四種物質A、B、C、D的物質的量變化如圖所示.已知:物質A、B、C均為氣態、D為固態,正反應是吸熱反應.根據要求回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
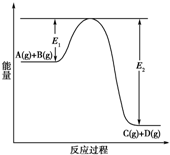 反應A(g)+B(g)?C(g)+D(g)過程中的能量變化如下圖所示,回答下列問題.
反應A(g)+B(g)?C(g)+D(g)過程中的能量變化如下圖所示,回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,則原溶液一定存在Ag+或SO42- | |
| B. | 根據纖維在火焰上燃燒產生的氣味,可確定該纖維是否為蛋白質纖維 | |
| C. | 兩份常溫下均為飽和溶液(一份是NaOH溶液,一份是氫氧化鈣溶液),上述兩份飽和溶液可通過加入少量的NaOH固體而鑒別出 | |
| D. | 某礦石中加入足量的鹽酸,根據放出的二氧化碳氣體,可證明該礦石一定含有碳酸鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com