
| MnO2的質量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2體積/mL | 49 | 61 | 86 |
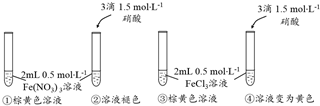
| 試管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加試劑 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 產生氣 泡情況 | 較快產生細小氣泡 | 緩慢產生細小氣泡 | 無氣泡產生 |
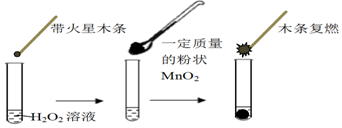
分析 (1)H2O2在MnO2催化作用下分解生成水和氧氣;
(2)根據表格中數據,二氧化錳質量的增加,相同時間內收集到氧氣的體積也相應增加,說明反應速率加快,從而得出結論;
(3)從所給的數據可知:試管Ⅰ、試管Ⅱ所用試劑的濃度、用量完全一樣,產生氣泡的快慢不一樣,說明不同催化劑對反應的催化效果不一樣,要對比Fe3+和Cu2+對H2O2分解反應的催化效果,必須排除溶液中的陰離子是否有催化作用,試管Ⅲ就很好的解決了這個問題;
(4)根據化合價的升降和催化劑會參加反應,但最終性質和質量不改變寫出反應方程式.
解答 解:(1)H2O2在MnO2催化作用下分解生成水和氧氣,反應的方程式為:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案為:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)根據表格中數據,在一定質量范圍內,二氧化錳質量的增加,相同時間內收集到氧氣的體積也相應增加,說明反應速率加快,原因是在一定質量范圍內,固體質量越大,其表面積也越大,故反應速率加快,催化效果更好;
故答案為:在一定質量范圍內,MnO2質量越大,反應速率越快;
(3)從所給的數據可知:試管Ⅰ、試管Ⅱ所用試劑的濃度、用量完全一樣,產生氣泡是試管Ⅰ快,試管Ⅱ慢,試管Ⅲ無氣泡產生,試管Ⅲ是一個對比實驗,說明Cl-對H2O2的分解沒有催化作用,從而得到Fe3+和Cu2+對H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好的結論,
故答案為:Fe3+和Cu2+對H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好;對比實驗,證明Cl-對H2O2的分解沒有催化作用;
(4)根據化合價的升降和催化劑會參加反應,但最終性質和質量不改變寫出反應方程式,FeCl3和H2O2反應,FeCl3中鐵元素化合價降低,生成氯化亞鐵,雙氧水中氧元素化合價升高,生成氧氣,方程式為:2FeCl3+H2O2=2FeCl2+O2↑+2HCl;FeCl3作催化劑,在第二個反應中重新生成,氯化亞鐵又被雙氧水氧化成氯化鐵,方程式為:2FeCl2+H2O2+2HCl=2FeCl3+2H2O;
故答案為:2FeCl2+H2O2+2HCl=2FeCl3+2H2O.
點評 本題考查了催化劑在反應中起到的作用,以及催化劑的質量大小對反應速率的影響探究,并考查了對比實驗的重要性,結合催化劑的特點分析催化機理,并對方程式進行推導,綜合性較強,題目難度中等.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2V正(B)=V逆(D) | |
| B. | 混合氣體的密度保持不變 | |
| C. | 混合氣體中B、C、D的濃度之比為2:2:1 | |
| D. | 混合氣體的壓強不隨時間變化而變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 100 mL 2 mol/L的鹽酸與鋅反應時,加入適量的氯化鈉溶液,生成氫氣的速率不變 | |
| B. | 用鐵片和稀硫酸反應制取氫氣時,改用鐵片和濃硫酸可以加快產生氫氣的速率 | |
| C. | 汽車尾氣中的CO和NO可以緩慢反應生成N2和CO2,加入催化劑,不影響CO的轉化率 | |
| D. | 二氧化硫的催化氧化是一個放熱反應,升高溫度,平衡逆向移動,正反應速率減慢 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1種 | B. | 2種 | C. | 3種 | D. | 4種 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 應量取濃鹽酸體積/mL | 應選用容量瓶的規格/mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
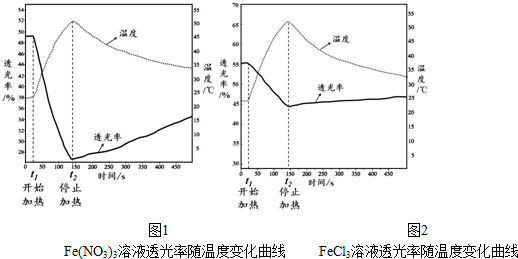
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
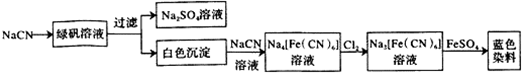
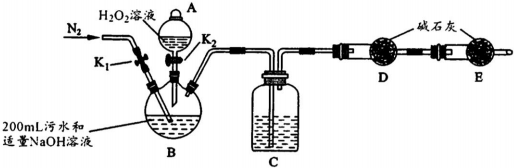
| 步驟1 | 關閉K1,打開K2,滴入足量H2O2溶液,對B加熱.充分反應后,停止加熱. |
| 步驟2 | 冷卻后,用注射器穿過B裝置的膠塞注入稀H2S04溶液. |
| 步驟3 | 打開K1,通入N2. |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com