
| A. | 1種 | B. | 2種 | C. | 3種 | D. | 4種 |
分析 ①若X為單質硫,M為氧氣符合轉化關系;
②若X為C,M為氧氣等符合轉化關系;
③若X為NaOH,M為CO2等符合轉化關系;
④若X為NH3,M為氧氣符合轉化關系.
解答 解:①若X為單質硫,M為氧氣,二者反應生成Y為SO2,SO2與氧氣繼續反應得到SO3,符合轉化關系,故①符合;
②若X為C.M為氧氣,二者反應得到Y為一氧化碳,一氧化碳與氧氣反應得到二氧化碳,符合轉化關系,故②符合;
③若X為NaOH,M為CO2,二者反應得到碳酸鈉,碳酸鈉與二氧化碳反應得到碳酸氫鈉,符合轉化關系,故③符合;
④若X為NH3,M為氧氣,二者反應得到NO,NO與氧氣反應得到二氧化氮,符合轉化關系,故④符合,
故選:D.
點評 本題考查無機物推斷,涉及硫、氮、鋁、鈉等元素化合物性質與轉化,熟練掌握元素化合物性質是關鍵,注意歸納總結中學常見X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z型轉化關系,難度中等.


 全程金卷系列答案
全程金卷系列答案 快樂5加2金卷系列答案
快樂5加2金卷系列答案科目:高中化學 來源: 題型:解答題
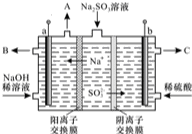 硫酸廠用煅燒黃鐵礦(FeS2)來制取硫酸,實驗室利用硫酸廠燒渣(主要成分是Fe2O3及少量FeS、SiO2)制備綠礬.
硫酸廠用煅燒黃鐵礦(FeS2)來制取硫酸,實驗室利用硫酸廠燒渣(主要成分是Fe2O3及少量FeS、SiO2)制備綠礬.
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對2HI(g)?H2(g)+I2(g)平衡體系增加壓強使顏色變深 | |
| B. | 反應CO(g)+NO2(g)?CO2(g)+NO(g)△H<0升高溫度使平衡向逆方向移動 | |
| C. | 合成氨反應:N2(g)+3H2(g)?2NH3(g)△H<0,為使氨的產率提高,理論上應采取低溫高壓的措施 | |
| D. | 在溴水中存在如下平衡:Br2(g)+H2O(l)?HBr(aq)+HBrO(aq),當加入NaOH溶液后顏色變淺 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
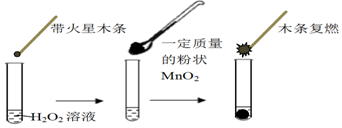
| MnO2的質量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2體積/mL | 49 | 61 | 86 |
| 試管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加試劑 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 產生氣 泡情況 | 較快產生細小氣泡 | 緩慢產生細小氣泡 | 無氣泡產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
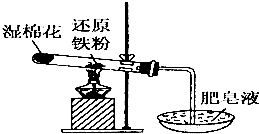 常溫下沒有氧氣存在時,鐵與水幾乎不反應,但高溫下,鐵與水蒸氣能反應.小明設計如下實驗探究鐵粉與水蒸氣反應后的氣體產物.
常溫下沒有氧氣存在時,鐵與水幾乎不反應,但高溫下,鐵與水蒸氣能反應.小明設計如下實驗探究鐵粉與水蒸氣反應后的氣體產物.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
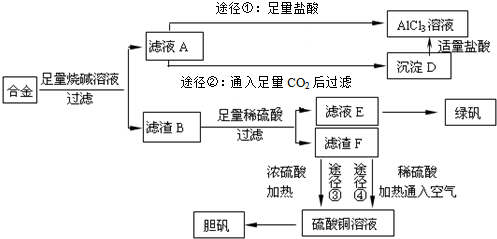
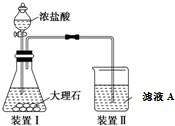
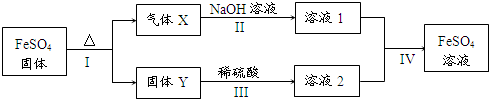
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com