
| A. | 2V正(B)=V逆(D) | |
| B. | 混合氣體的密度保持不變 | |
| C. | 混合氣體中B、C、D的濃度之比為2:2:1 | |
| D. | 混合氣體的壓強不隨時間變化而變化 |
分析 當化學反應達到平衡狀態時,正逆反應速率相等,各物質的濃度不再發生變化,由此衍生的一些物理性不變,以此解答該題.
解答 解:A.V正(B)=2V逆(D),說明正逆反應速率相等,才可以判斷是否達到平衡狀態,故A錯誤;
B.氣體質量不變,體積不變,則平衡混合氣體的密度始終保持不變,所以不一定達到平衡狀態,故B錯誤;
C.混合氣體中B、C、D的濃度之比為2:2:1不能說明正逆反應速率相等,不能判斷是否達到平衡狀態,故C錯誤;
D.該反應是一個反應前后氣體體積改變的反應,混合氣體的總壓強不變,該反應達到平衡狀態,故D正確;
故選D.
點評 本題考查化學平衡狀態的判斷,題目難度不大,易錯選項是B,注意雖然容器的體積不變,但反應前后氣體的總質量發生變化,所以平均相對分子質量發生變化,所以可以據此判斷是否達到平衡狀態.


科目:高中化學 來源: 題型:選擇題
| 選項 | 項目 | 氨堿法 | 聯合制堿法 |
| A. | 原料 | 食鹽、氨氣、生石灰 | 食鹽、氨氣、二氧化碳 |
| B. | 可能的副產物 | 氯化鈣 | 氯化銨 |
| C. | 循環物質 | 氨氣、二氧化碳 | 氨氣、氯化鈉 |
| D. | 評價 | 原料易得、產率高 | 設備簡單、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
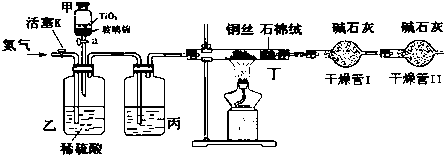
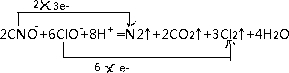 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
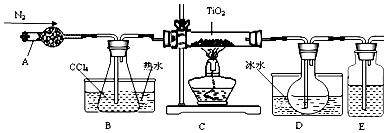
| 物質 | 熔點/℃ | 沸點/℃ | 其他 |
| CCl4 | -23 | 76 | 與TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮濕空氣產生白霧 |
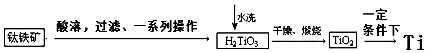
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 麻古(冰毒片劑) | B. | K粉(氯胺酮) | C. | 大麻(四氫大麻酚) | D. | 抗酸藥 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
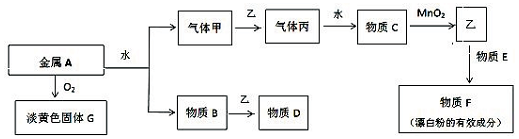
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
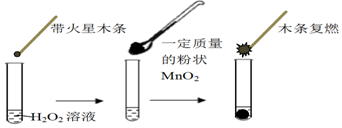
| MnO2的質量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2體積/mL | 49 | 61 | 86 |
| 試管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加試劑 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 產生氣 泡情況 | 較快產生細小氣泡 | 緩慢產生細小氣泡 | 無氣泡產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
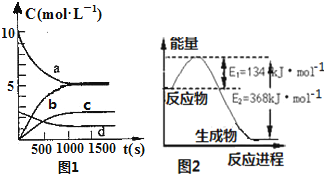 氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一.
氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com