
| A. | 0.1mol•L-1的Na3PO4溶液中:c(Na+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-) | |
| B. | 0.1mol•L-1的NaHS溶液中:c(H+)+c(H2S)=c(OH-)+c(S2-) | |
| C. | 0.1mol•L-1的氨水與0.1mol•L-1的NaHSO4溶液等體積混合:c(Na+ )=c(SO42-)=c(NH4+)>C(H+)>C(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液與0.1mol•L-1的NaHCO3溶液等體積混合:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
分析 A.根據磷酸鈉溶液中的物料守恒判斷;
B.根據硫氫化鈉溶液中的質子守恒判斷;
C.二者反應后生成等濃度的硫酸鈉、硫酸銨,銨根離子部分水解,則c(Na+ )=c(SO42-)>c(NH4+);
D.碳酸根離子的水解程度大于碳酸氫根離子,則c(HCO3-)>c(CO32-).
解答 解:A.0.1mol•L-1的Na3PO4溶液中,根據物料守恒可得:c(Na+)=3c(PO43-)+3c(HPO42-)+3c(H2PO4-),故A錯誤;
B.0.1mol•L-1的NaHS溶液中,根據質子守恒可得:c(H+)+c(H2S)=c(OH-)+c(S2-),故B正確;
C.0.1mol•L-1的氨水與0.1mol•L-1的NaHSO4溶液等體積混合,二者恰好反應生成等濃度的硫酸鈉、硫酸銨,銨根離子部分水解,溶液顯示酸性,則溶液中正確的離子濃度大小為:c(Na+ )=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故C錯誤;
D.0.1mol•L-1的Na2CO3溶液與0.1mol•L-1的NaHCO3溶液等體積混合,由于碳酸根離子的水解程度大于碳酸氫根離子,則c(HCO3-)>c(CO32-),溶液中正確的離子濃度大小為:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-),故D錯誤;
故選B.
點評 本題考查了離子濃度大小比較,題目難度中等,明確混合液中溶質組成及鹽的水解原理為解答關鍵,注意掌握根據電荷守恒、物料守恒及質子守恒判斷溶液中離子濃度大小的方法.


 100分闖關期末沖刺系列答案
100分闖關期末沖刺系列答案科目:高中化學 來源:2016-2017學年河南省高一上月考二化學試卷(解析版) 題型:填空題
填寫下列空白:
(1)標準狀況下,1.1 g某氣態氧化物RO2的體積為0.56 L。該氣體的摩爾質量是 。
(2)標準狀況下,密度為1.25 g·L-1的CO2與CH4組成的混合氣體中,CO2的體積分數為 ,該混合氣體對氫氣的相對密度為 。
(3)某結晶水合物的化學式為A·nH2O,A的相對分子質量為M。如將a g該化合物加熱至結晶水全部失去,剩余的殘渣為b g,則n= 。
(4)將標準狀況下體積為a L的HCl氣體溶于1000g水中,得到鹽酸的密度為b g/cm3,則該鹽酸的物質的量濃度為 mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
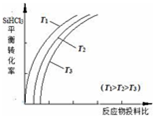 含硅元素的化合物廣泛存在于自然界中,與其他礦物共同構成巖石.晶體硅(熔點 1410℃)用途廣泛,制取與提純方法有多種.
含硅元素的化合物廣泛存在于自然界中,與其他礦物共同構成巖石.晶體硅(熔點 1410℃)用途廣泛,制取與提純方法有多種.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 維生素C具有還原性,在人體內起抗氧化作用 | |
| B. | “加碘食鹽”、“含氟牙膏”、“富硒營養品”、“高鈣牛奶”、“加鐵醬油”等等,這里的碘、氟、硒指的是化合物,鈣、鐵則分別是Ca2+和Fe3+ | |
| C. | 發生地震后,防疫人員在震區周圍撒石灰,進行環境消毒,防止災后出現疫情 | |
| D. | 為防止中秋月餅等富脂食品氧化變質,常在包裝袋中放入硫酸亞鐵等還原性物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
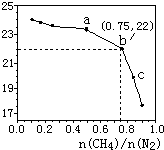 已知:在700℃的恒溫、恒容密閉容器中發生反應3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4與N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$時CH4的平衡轉化率如圖所示,下列說法正確的是( )
已知:在700℃的恒溫、恒容密閉容器中發生反應3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4與N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$時CH4的平衡轉化率如圖所示,下列說法正確的是( )| A. | n(CH4)/n(N2)越大,CH4的轉化率越高 | |
| B. | a點對應的平衡常數比c點的大 | |
| C. | b點對應的NH3的體積分數為26% | |
| D. | 不改變投料比,增加n(N2)時,NH3體積分數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
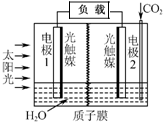 利用人工模擬光合作用合成甲酸的原理為:
利用人工模擬光合作用合成甲酸的原理為:| A. | 電極1周圍pH增大 | |
| B. | 電子由電極1經過負載流向電極2 | |
| C. | 電極2的反應式:CO2+2H++2e-=HCOOH | |
| D. | 該裝置能將太陽能轉化為化學能和電能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
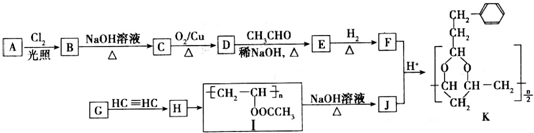
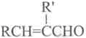 +H2O(R,R′表示烴基或氫)
+H2O(R,R′表示烴基或氫)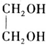 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$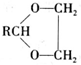 +H2O
+H2O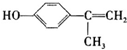 (寫結構簡式).
(寫結構簡式).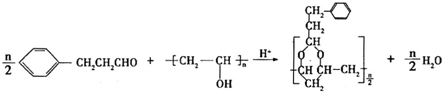 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com