
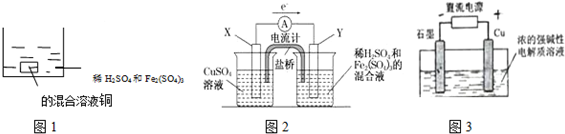
| A. | 如圖1 所示將一定量的銅片加入到100 mL 稀硫酸和硫酸鐵的混合溶液中,若銅片完全溶解時(不考慮鹽的水解及溶液體積的變化),溶液中的Fe3+、Cu2+、H+三種離子的物質的量濃度相等,且測得溶液的pH=1,則溶液中c(SO42-)為0.5mol/L | |
| B. | 如圖2 所示的裝置中發生Cu+2Fe3+═Cu2++2Fe2+的反應,X 極是負極,Y 極的材料名稱可以是銅 | |
| C. | Cu2O 是一種半導體材料,基于綠色化學理念設計的制取.Cu2O 的電解池示意圖如圖3所示,石墨電極上產生氫氣,銅電極發生還原反應 | |
| D. | 如圖3 所示當有0.1mol 電子轉移時,有0.1molCu2O 生成 |
分析 A.根據溶液中的電荷守恒計算;
B.由電子轉移方向可知X為負極,Y為正極,負極應為Cu;
C.Cu被氧化生成Cu2O,應為電解池的陽極反應;
D.根據電極方程式2Cu-2e-+2OH-=Cu2O+H2O計算.
解答 解:A.溶液的pH=1,則c(H+)=0.1mol/L,由電荷守恒可知:3c(Fe3+)+2c(Cu2+)+c(H+)+2c(Fe2+)=2c(SO42-),且溶液中的Fe3+、Cu2+、H+三種離子的物質的量濃度相等,由Cu+2Fe3+═Cu2++2Fe2+可知,c(Fe2+)=0.2mol/L,可解得:c(SO42-)=0.5mol/L,故A正確;
B.由電子轉移方向可知X為負極,Y為正極,負極應為Cu,Y極的材料可以活潑性比銅弱的金屬或非金屬,故B錯誤;
C.Cu被氧化生成Cu2O,應為電解池的陽極反應,發生氧化反應,故C錯誤;
D.電極方程式為2Cu-2e-+2OH-=Cu2O+H2O,當有0.1mol電子轉移時,有0.05mol Cu2O生成,故D錯誤;
故選A.
點評 本題考查化學實驗方案的評價,為高頻考點,側重于學生的分析能力、計算能力的考查,注意把握電極方程式的書寫,易錯點為A,注意從電荷守恒的角度解答,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 加入金屬鎂產生H2的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| B. | 含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- | |
| C. | c(Cu2+)=0.1 mol•L-1的溶液中:H+、NH4+、Br-、CO32- | |
| D. | 含有大量MnO4-的溶液中:H+、SO42-、Cl-、CH3CH2OH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中一定含有離子鍵 | |
| B. | 有機聚合高分子中只含有單鍵 | |
| C. | 乙醇、乙醛和乙酸互為同分異構體 | |
| D. | 纖維素屬于天然高分子化合物,分子中含有碳氫兩種元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 聚四氟乙烯有固定的熔點 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反應均為加聚反應 | |
| C. | 聚全氟乙丙烯分子的結構簡式可能為 | |
| D. | ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的連接方式 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 若c1=2c2,則w1<2w2,V<100mL | B. | 若c1=2c2,則w1>2w2,V>100mL | ||
| C. | 若w1=2w2,則c1>2c2,V=100mL | D. | 若w1=2w2,則c1>2c2,V<100mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑由小到大的順序:X<Y<Z<W | |
| B. | Z的最高價氧化物能與水反應生成相應的酸 | |
| C. | 室溫下,0.1 mol/L W的氣態氫化物的水溶液的pH>1 | |
| D. | Y單質在一定條件下可以與氧化鐵發生置換反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濕法煉銅和火法煉銅的反應中,銅元素都發生還原反應 | |
| B. | 加強熱,使CuO在高溫條件下分解制備單質Cu | |
| C. | 黑色金屬材料包括鐵、鉻、錳及其化合物 | |
| D. | 生鐵與鋼的區別在于生鐵含碳雜質,而鋼不含 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com