
| A. | 原子半徑由小到大的順序:X<Y<Z<W | |
| B. | Z的最高價氧化物能與水反應生成相應的酸 | |
| C. | 室溫下,0.1 mol/L W的氣態氫化物的水溶液的pH>1 | |
| D. | Y單質在一定條件下可以與氧化鐵發生置換反應 |
分析 X、Y、Z、W是分別位于第2、3周期的元素,原子序數依次遞增,Y元素的單質既能與鹽酸反應也能與NaOH溶液反應,則Y為Al,Z原子的最外層電子數是次外層電子數的一半,則Z為Si元素,X與Z位于同一主族,可知X為C元素,Y、Z、W原子的最外層電子數之和為14,則W的最外層電子數為14-3-4=7,則W為Cl,然后結合元素周期律及元素化合物知識來解答.
解答 解:X、Y、Z、W是分別位于第2、3周期的元素,原子序數依次遞增,Y元素的單質既能與鹽酸反應也能與NaOH溶液反應,則Y為Al,Z原子的最外層電子數是次外層電子數的一半,則Z為Si元素,X與Z位于同一主族,可知X為C元素,Y、Z、W原子的最外層電子數之和為14,則W的最外層電子數為14-3-4=7,則W為Cl,
A.電子層越多原子半徑越大,同周期原子序數大的原子半徑小,則原子半徑由小到大的順序:X<W<Z<Y,故A錯誤;
B.Z的最高價氧化物為二氧化硅,與水不反應,故B錯誤;
C.室溫下,0.1 mol/L W的氣態氫化物的水溶液為鹽酸,其pH=1,故C錯誤;
D.Y單質在一定條件下可以與氧化鐵發生置換反應生成Fe和氧化鋁,為鋁熱反應,故D正確;
故選D.
點評 本題考查原子結構與元素周期律,為高頻考點,把握元素化合物知識與原子結構推斷元素為解答的關鍵,側重分析與應用能力的考查,注意元素化合物知識的應用,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
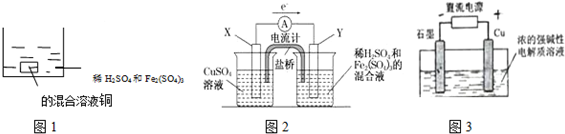
| A. | 如圖1 所示將一定量的銅片加入到100 mL 稀硫酸和硫酸鐵的混合溶液中,若銅片完全溶解時(不考慮鹽的水解及溶液體積的變化),溶液中的Fe3+、Cu2+、H+三種離子的物質的量濃度相等,且測得溶液的pH=1,則溶液中c(SO42-)為0.5mol/L | |
| B. | 如圖2 所示的裝置中發生Cu+2Fe3+═Cu2++2Fe2+的反應,X 極是負極,Y 極的材料名稱可以是銅 | |
| C. | Cu2O 是一種半導體材料,基于綠色化學理念設計的制取.Cu2O 的電解池示意圖如圖3所示,石墨電極上產生氫氣,銅電極發生還原反應 | |
| D. | 如圖3 所示當有0.1mol 電子轉移時,有0.1molCu2O 生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO3+H2O=H2SO4 | B. | CH2=CH2+HClO→CH3-CHOH | ||
| C. | CH3Cl+Cl2→CH2Cl2+HCl | D. | CO2+2NaOH=Na2CO3+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 僅由碳、氫兩種元素組成 | B. | 僅由碳、氫、氧三種元素組成 | ||
| C. | 在氧氣中燃燒只生成二氧化碳 | D. | 熔點低而且難溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 充電時,反應每生成2mol H+時電子轉移的物質的量為2mol | |
| B. | 放電過程中,正極附近溶液的酸性減弱 | |
| C. | 放電時,正極反應為VO2++2H++e-=VO2++H2O | |
| D. | 充電時,陽極附近溶液由藍色逐漸變為黃色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 編號 | 金屬(粉末狀)(mol) | 酸的濃度及體積 | 反應溫度(℃) |
| A | Mg,0.1 | 6mol•L-1硝酸10mL | 60 |
| B | Mg,0.1 | 3mol•L-1鹽酸10mL | 60 |
| C | Fe,0.1 | 3mol•L-1鹽酸100mL | 60 |
| D | Mg,0.1 | 3mol•L-1硫酸5mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
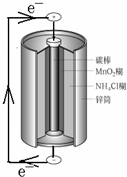
| A. | 鋅筒作負極,發生氧化反應 | |
| B. | 電子從鋅流向碳棒,碳棒得電子被還原 | |
| C. | 電池內部的NH4+向碳棒移動 | |
| D. | 將NH4Cl更換為KOH能提高電池壽命和性能 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com