
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
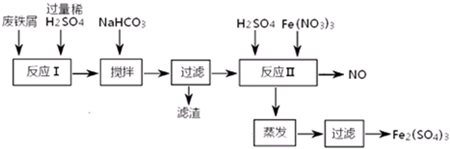
分析 由流程可知,Fe、Al和稀硫酸反應生成FeSO4、Al2(SO4)3和氫氣,向混合溶液中加入NaHCO3,調節溶液的pH,根據沉淀物與pH的關系知,要是鋁離子產生沉淀,則pH應該在4.4-7.5之間,然后過濾得到濾液,向濾液中加入稀硫酸、硝酸鐵,酸性條件下,亞鐵離子被氧化生成鐵離子,同時生成NO,然后采用蒸發濃縮、冷卻結晶、過濾得到Fe2(SO4)3,以此來解答.
解答 解:由流程可知,Fe、Al和稀硫酸反應生成FeSO4、Al2(SO4)3和氫氣,向混合溶液中加入NaHCO3,調節溶液的pH,根據沉淀物與pH的關系知,要是鋁離子產生沉淀,則pH應該在4.4-7.5之間,然后過濾得到濾液,向濾液中加入稀硫酸、硝酸鐵,酸性條件下,亞鐵離子被氧化生成鐵離子,同時生成NO,然后采用蒸發濃縮、冷卻結晶、過濾得到Fe2(SO4)3,
①加NaHCO3時,混合液pH值應控制在Al(OH)3完全沉淀、Fe(OH)2不產生沉淀,根據沉淀物與pH的關系知,要是鋁離子產生沉淀,則pH應該在4.4-7.5之間,
故答案為:4.4~7.5
②酸性條件下,硝酸根離子和亞鐵離子發生氧化還原反應,離子方程式為3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案為:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反應Ⅱ中需要強氧化性的酸將二價鐵離子氧化,一氧化氮有毒,但一氧化氮易與氧氣反應生成二氧化氮,二氧化氮和水反應生成硝酸,總的反應為4NO+3O2+2H2O=4HNO3,將O2和反應Ⅱ產生的NO,按3:4配比混合后重新通入反應Ⅱ中,可節約Fe(NO3)3、防止NO污染,
故答案為:節約Fe(NO3)3、防止NO污染;3:4.
點評 本題考查物質的制備實驗,為高頻考點,把握流程中的反應及混合物分離為解答本題的關鍵,注意酸性條件下硝酸根離子具有強氧化性,側重分析與實驗能力的考查,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 轉移電子4.8NA個 | B. | 生成氣體的體積42.56L(標準狀況) | ||
| C. | 還原劑比氧化劑多0.2mol | D. | 被還原的氮原子是11.2g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,0.05NA個CO2分子所占的體積是1.12L | |
| B. | 1mol 氧氣所含有的原子數為NA | |
| C. | 常溫常壓下,32g O2和34g H2S氣體分子個數比為1:1 | |
| D. | 11.2L NH3中所含的質子數為5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗現象 | 原因 |
| 溶液最初從紫色逐漸變為紅色 | 氯氣與水反應生成的H+使石蕊變色 |
| 隨后溶液逐漸變為無色 | 氯氣與水反應生成次氯酸具有漂白性 |
| 然后溶液從無色逐漸變為淺黃綠色 | 過量氯氣溶解于水中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗步驟 | 預期現象和結論 |
步驟1:取少量沉淀于試管中,加入足量0.1 mol•L-1 HCl . | 沉淀全部溶解,有氣泡產生,說明沉淀中有CaCO3 |
步驟2:往步驟1的剩余物中,再滴加幾滴0.01 mol•L-1 KMnO4 . | 溶液紫紅色褪去,說明沉淀中有CaC2O4,結合步驟1,假設2成立 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol | B. | 3mol | C. | 4mol | D. | 6mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 已知鉛蓄電池的總反應PbO2+Pb+2H2SO4 $?_{充電}^{放電}$ 2PbSO4+2H2O,圖為鐵鉚釘鉚在銅板上,有關敘述不正確的是( )
已知鉛蓄電池的總反應PbO2+Pb+2H2SO4 $?_{充電}^{放電}$ 2PbSO4+2H2O,圖為鐵鉚釘鉚在銅板上,有關敘述不正確的是( )| A. | 鉛蓄電池放電時,電路中每轉移2mol電子,生成1mol硫酸鉛 | |
| B. | 如圖,鐵鉚釘發生吸氧腐蝕,在鐵釘附近滴加K3[Fe(CN)6]溶液,可觀察鐵釘附近有藍色沉淀產生 | |
| C. | 鉛蓄電池充電時,陽極電極反應為 PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 鉛蓄電池放電時,內電路硫酸根離子向鉛極移動,正極附近溶液的pH增大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com