
 碳、氮和鋁的單質及其化合物在工農業生產和生活中有重要的作用.
碳、氮和鋁的單質及其化合物在工農業生產和生活中有重要的作用.| 時間(min) 濃度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
分析 (1)依據熱化學方程式和蓋斯定律計算得到對應反應的焓變;
(2)①依據平衡常數是利用平衡狀態生成物物質的濃度的冪次方乘積除以反應物平衡濃度的冪次方乘積計算得到;
②反應前后是氣體體積不變的反應,圖表數據分析可知一氧化氮,氮氣,二氧化碳濃度都增大,說明改變的條件是縮小體積增大濃度,或加入一氧化氮達到新平衡后個物質濃度增大;
③容器中NO、N2、CO2的濃度之比為3:1:1,平衡向逆反應方向移動,升溫平衡向吸熱反應方向進行;
④依據影響化學平衡的因素和平衡移動原理分析判斷;
(3)由原電池總反應可知,原電池工作時Al被氧化,應為電池的負極,電極反應為Al-3e-+4OH-=AlO2-+2H2O,AgO被還原,應為原電池的正極,電極反應式為Ag2O+2e-+H2O=2Ag+2OH-,結合電極反應式進行判斷.依據電子守恒計算溶液中氫氧根離子濃度結合離子積計算氫離子濃度,計算溶液PH.
解答 解:(1)①2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g);△H=a kJ•mol-1
②3AlCl(g)=2Al(l)+AlCl3(g);△H=b kJ•mol-1
依據蓋斯定律①×3+②×6得到:6Al2O3(s)+18C(s)=12Al(l)+18CO(g)△H=(3a+6b)KJ/mol,即Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=(0.5a+b)KJ/mol,
故答案為:0.5a+b;
(2)①化學平衡三段式列式計算平衡濃度:
C(s)+2NO(g)?N2(g)+CO2(g);
起始量(mol/L) 1 0 0
變化量(mol/L) 0.5 0.25 0.25
平衡量(mol/L) 0.5 0.25 0.25
K=$\frac{0.25mol/L×0.25mol/L}{(0.5mol/L){\;}^{2}}$=0.25,
故答案為:0.25;
②30min后,只改變某一條件,反應重新達到平衡,圖表數據分析可知一氧化氮,氮氣,二氧化碳濃度都增大;
a.通入一定量的NO,反應正向進行,達到平衡后一氧化氮、氮氣、二氧化碳濃度增大,故a符合;
b.加入一定量的活性炭是固體,對平衡無影響,故b不符合;
c.加入合適的催化劑,只能改變化學反應速率,不能改變平衡,濃度不變,故c不符合;
d.適當縮小容器的體積,反應前后是氣體體積不變的反應,平衡不動,但個物質濃度增大,符合要求,故d符合;
故答案為:a d;
③若30min后升高溫度至T2℃,達到平衡時,容器中NO、N2、CO2的濃度之比為3:1:1,平衡向逆反應方向移動,說明逆反應是吸熱反應,則正反應是放熱反應,故選<;
故答案為:<;
④恒容條件下,體積不變. a、無論反應是否達到平衡狀態,單位時間內生成2n mol NO(g)的同時消耗n mol CO2(g),故a錯誤;
b、該反應是放熱反應,所以反應體系的溫度隨著反應的移動而改變,當平衡時,反應體系的溫度不變,故b正確;
C、反應中有固體參加,反應前后氣體的質量不等,所以當反應達到平衡時,混合氣體的密度不再變化,故c正確;
d、無論反應是否達到平衡狀態,壓強始終不變,故d錯誤.
故答案為:bc;
(3)正極上氧化銀得電子和水反應生成銀和氫氧根離子,電極反應式為:Ag2O+2e-+H2O=2Ag+2OH-;根據反應中得失電子數相等計算,消耗27mg Al失去電子0.003mol,則需要氫氧根離子的物質的量=0.003mol,溶液中增加氫離子物質的量為0.003mol,則溶液中氫離子的濃度=$\frac{0.003mol}{0.3L}$=0.01mol/L,pH=-lg0.01mol/L=2.
故答案為:Ag2O+2e-+H2O=2Ag+2OH-;2
點評 本題考查了熱化學方程式和蓋斯定律的計算應用,化學平衡的影響因素分析化學平衡移動原理的應用,平衡常數計算判斷,原電池原理和電極反應書寫方法和電子轉移守恒計算,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃度均為0.1mol•L-1的小蘇打溶液與燒堿溶液等體積混合:2c(CO${\;}_{3}^{2-}$)+c(OH-)+c(HCO${\;}_{3}^{-}$)-c(H+)=0.1mol•L-1 | |
| B. | 濃度均為0.1mol•L-1的硫酸氫銨溶液與氫氧化鈉溶液等體積混合c(SO${\;}_{4}^{2-}$)>c(Na+)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| C. | pH=12的氨水與pH=2的鹽酸等體積混合c(Cl-)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| D. | 濃度均為0.1mol•L-1的醋酸溶液與氫氧化鈉溶液等體積混合c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
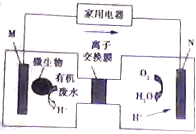 有媒體報道一種新型污水處理裝置問世,該裝置可利用一種微生物將有機物廢水的化學能直接轉化為電能,該裝置的構造如圖所示.下列說法中正確的是( )
有媒體報道一種新型污水處理裝置問世,該裝置可利用一種微生物將有機物廢水的化學能直接轉化為電能,該裝置的構造如圖所示.下列說法中正確的是( )| A. | 裝置外電路中箭頭的方向代表電流的方向 | |
| B. | 該裝置為原電池,其中N為負極 | |
| C. | 標準狀況下,N電極每消耗11.2L氣體時會有4NA離子通過離子交換膜 | |
| D. | 若有機廢水中含有葡萄糖,則M電極發生的電極反應為:C6H12O6+6H2O-24e-═6CO2+24H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數c>b | B. | 原子半徑X<W | ||
| C. | 離子半徑Y2-<Z- | D. | 離子的氧化性W3+>X+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所占硫原子的物質的量之比為1:1 | B. | 氧原子的物質的量之比為2:3 | ||
| C. | 氧元素的質量比為2:3 | D. | 體積比為1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數數為60 | B. | 質量數為27 | C. | 核外電子數為14 | D. | 中子數為33 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com