
分析 (1)根據外界條件對平衡的影響來確定平衡移動方向,從而確定溶液顏色變化;
(2)根據判斷平衡狀態的方法:V正=V逆,或各組分的濃度保持不變則說明已達平衡,也可根據化學平衡狀態的特征:逆、定、動、變、等來回答判斷;
(3)在氧化還原反應中,化合價升高值=化合價降低值=轉移電子數來計算;
(4)根據Ksp=c(Cr3+)•c3(OH-)來計算氫氧根離子離子的濃度,并計算氫離子濃度和pH的大小;Cr(OH)3是難溶電解質,在溶液中存在沉淀溶解平衡;
(5)陽極是活性電極時,陽極本身失電子,生成陽離子;
(6)溶液PH升高的原因是溶液中氫離子濃度減少,即氫離子在陰極得電子,PH升高,氫氧根離子濃度增大,離子濃度冪的乘積大于溶度積,所以金屬陽離子會生成氫氧化物沉淀.
解答 解:(1)c(H+)增大,平衡2CrO42-(黃色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案為:橙;
(2)對于平衡:2CrO42-(黃色)+2H+?Cr2O72-(橙色)+H2O,
A.Cr2O72-和CrO42-的濃度相同,不一定平衡,故A錯誤;
B.2υ(Cr2O72-)=υ(CrO42-)不能證明正逆速率相等,所以不是平衡狀態,故B錯誤;
C.溶液的顏色不變,即有色離子濃度不會再不變,達到了化學平衡狀態,故C正確;
故答案為:C;
(3)還原1mol Cr2O72-離子,鉻元素化合價從+6價降低到+3價,一共得到電子6mol,亞鐵離子被氧化為+3價,應該得到6mol電子,所以還原1mol Cr2O72-離子,需要6mol的FeSO4•7H2O,
故答案為:6;
(4)Cr(OH)3的溶度積Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,則需c(OH-)=$\root{3}{\frac{Ksp}{c(C{r}^{3+})}}$=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5;Cr(OH)3是難溶電解質,在溶液中存在沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq);
故答案為:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq);5;
(5)在電解法除鉻中,鐵作陽極,陽極反應為Fe-2e-═Fe2+,以提供還原劑Fe2+,故答案為:陽極反應為Fe-2e-=Fe2+,提供還原劑Fe2+;
(6)在陰極附近溶液pH升高的原因是水電離產生的H+放電生成H2:2H++2e-═H2↑;同時大量產生了OH-,所以溶液中的Fe3+也將轉化為Fe(OH)3沉淀;
故答案為:2H++2e-=H2↑;Fe(OH)3.
點評 本題主要考查了鉻及其化合物的性質、氧化還原反應、沉淀溶解平衡和電化學知識等內容,難度中等,抓住題目信息是解題的關鍵,注意把握氧化還原反應原理以及溶度積在計算中的應用.


 輕巧奪冠周測月考直通名校系列答案
輕巧奪冠周測月考直通名校系列答案科目:高中化學 來源: 題型:多選題
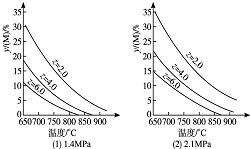 反應aM(g)+bN(g)?cP(g)+dQ(g)達到平衡時,M的體積分數y(M)與反應條件的關系如圖所示.其中z表示反應開始時N的物質的量與M的物質的量之比.下列說法不正確的是( )
反應aM(g)+bN(g)?cP(g)+dQ(g)達到平衡時,M的體積分數y(M)與反應條件的關系如圖所示.其中z表示反應開始時N的物質的量與M的物質的量之比.下列說法不正確的是( )| A. | 同溫同壓同z時,加入催化劑,平衡時Q的體積分數不改變 | |
| B. | 同溫同壓時,增加z,平衡時Q的體積分數一定增加 | |
| C. | 同溫同z時,增加壓強,平衡時Q的體積分數一定減小 | |
| D. | 同壓同z時,升高溫度,平衡時Q的體積分數一定增加 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
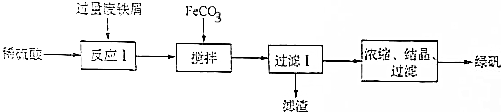

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
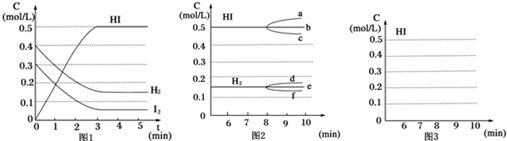
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 發生的反應都是置換反應 | B. | 實驗所得濾液是純水,可直接排放 | ||
| C. | 濾渣中一定含銅和鋅 | D. | 反應前后液體的酸性減弱,pH變小 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 容器編號 | 起始時各物質物質的量/mol | 平衡時反應中的能量 變化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出熱量a kJ |
| ② | 0 | 0 | 2 | 吸收熱量b kJ |
| ③ | 2 | 6 | 0 | 放出熱量c kJ |
| A. | 熱量關系:a+b=92.4 | B. | 三個容器內反應的平衡常數:③>①=② | ||
| C. | 平衡時氨氣的體積分數:①=②>③ | D. | ①N2的轉化率+②NH3的轉化率=100% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com