
| A、c(OH-)/c(NH3?H2O) |
| B、c(NH3?H2O)/c(OH-) |
| C、c(H+)和c(OH-)的乘積 |
| D、c(H+) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
| A、氯氣溶于水:Cl2+H2O?H++Cl-+HClO | ||||
B、MnO2 與濃鹽酸反應制Cl2:MnO2+4HCl
| ||||
| C、Na2O2溶于水產生O2:Na2O2+H2O═2Na++2OH-+O2↑ | ||||
| D、向NaHCO3溶液中加過量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 如圖中,圖1為甲烷和O2構成的燃料電池,圖2為電解MgCl2溶液的裝置.用該裝置進行實驗,反應開始后,觀察到x電極附近出現白色沉淀.下列說法正確的是( )
如圖中,圖1為甲烷和O2構成的燃料電池,圖2為電解MgCl2溶液的裝置.用該裝置進行實驗,反應開始后,觀察到x電極附近出現白色沉淀.下列說法正確的是( )| A、A處通入的氣體為O2,B處通入的氣體為CH4 |
| B、電池內部K+向b極移動,OH-向a極移動 |
| C、圖1裝置中發生的總反應為CH4+2O2═CO2+2H2O |
| D、圖1、圖2中電解質溶液的pH均增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:
A、(
| ||||
| B、( 2b-a ) mol/L | ||||
C、( 5b-
| ||||
| D、( l0b-5a )mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
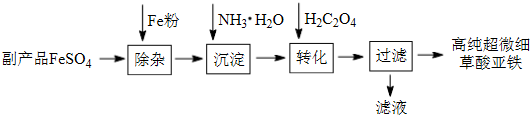
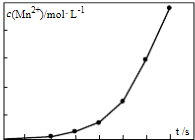
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com