
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,濃度減低,Al(OH)3不斷溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,濃度減低,Al(OH)3不斷溶解.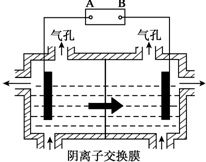
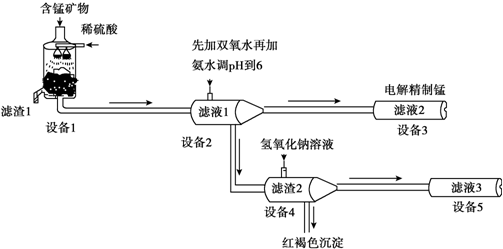
分析 錳礦物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等,用硫酸溶解,SiO2不硫酸反應,MnCO3、FeCO3、Al2O3與硫酸反應得到MnSO4、FeSO4、Al2(SO4)3,而濾液1里錳元素只以Mn2+的形式存在,且濾渣1中也無MnO2,酸性條件下MnO2將Fe2+離子氧化為Fe3+離子,過濾除去二氧化硅等不溶物,濾渣1為SiO2等不溶物.濾液1中加入過氧化氫將Fe2+離子氧化為Fe3+離子,再加入氨水調節溶液pH使Fe3+、Al3+轉化為Fe(OH)3、Al(OH)3沉淀,過濾分離,濾液2中含有MnSO4、NH4SO4等,濾渣2為Fe(OH)3、Al(OH)3,向濾渣2中加入氫氧化鈉,氫氧化鋁溶解得到NaAlO2,過濾分離.濾液2電解得到Mn.
(1)濾渣1的主要成分是二氧化硅;
(2)設備1中發生氧化還原反應:二氧化錳在酸性條件下將+2價鐵氧化為鐵離子,二氧化硫被還原得到Mn2+;
(3)設備2中加足量雙氧水將Fe2+離子氧化為Fe3+離子;利用加入鐵氰化鉀溶液檢驗Fe2+離子;
(4)Al(OH)3存在電離平衡:Al3++3OH- Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,平衡正向移動,氫氧化鋁被溶解;
AlO2-+H++H2O,加入NaOH溶液,H+被中和,平衡正向移動,氫氧化鋁被溶解;
(5)①電解裝置中箭頭表示溶液中陰離子移動的方向,則左室為陰極室,右室為陽極室,A為電源的負極,B為電源的陽極,陽極以稀硫酸為電解液,溶液中氫氧根離子放電生成氧氣;
②Mn2+進入陽極區,發生氧化反應生成MnO2,需要有水參與反應,根據電荷守恒可知有氫離子生成.
解答 解:錳礦物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等,用硫酸溶解,SiO2不硫酸反應,MnCO3、FeCO3、Al2O3與硫酸反應得到MnSO4、FeSO4、Al2(SO4)3,而濾液1里錳元素只以Mn2+的形式存在,且濾渣1中也無MnO2,酸性條件下MnO2將Fe2+離子氧化為Fe3+離子,過濾除去二氧化硅等不溶物,濾渣1為SiO2等不溶物.濾液1中加入過氧化氫將Fe2+離子氧化為Fe3+離子,再加入氨水調節溶液pH使Fe3+、Al3+轉化為Fe(OH)3、Al(OH)3沉淀,過濾分離,濾液2中含有MnSO4、NH4SO4等,濾渣2為Fe(OH)3、Al(OH)3,向濾渣2中加入氫氧化鈉,氫氧化鋁溶解得到NaAlO2,過濾分離.濾液2電解得到Mn.
(1)濾渣1的主要成分是SiO2,故答案為:SiO2;
(2)設備1中發生氧化還原反應:二氧化錳在酸性條件下將+2價鐵氧化為鐵離子,二氧化硫被還原得到Mn2+,反應離子方程式為:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2↑+4H2O,
故答案為:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2↑+4H2O;
(3)設備2中加足量雙氧水將Fe2+離子氧化為Fe3+離子,便于調節pH時轉化為沉淀除去,檢驗濾液2中是否存在Fe2+的方案為:取濾液2,加入鐵氰化鉀溶液,如果有藍色沉淀產生,則有Fe2+,否則沒有Fe2+,
故答案為:將Fe2+完全氧化為Fe3+;取濾液2,加入鐵氰化鉀溶液,如果有藍色沉淀產生,則有Fe2+,否則沒有Fe2+;
(4)濾渣2中存在Al(OH)3,存在電離平衡:Al3++3OH- Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,濃度減低,Al(OH)3不斷溶解,
AlO2-+H++H2O,加入NaOH溶液,H+被中和,濃度減低,Al(OH)3不斷溶解,
故答案為:濾渣2中存在Al(OH)3,存在電離平衡:Al3++3OH- Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,濃度減低,Al(OH)3不斷溶解;
AlO2-+H++H2O,加入NaOH溶液,H+被中和,濃度減低,Al(OH)3不斷溶解;
(5)①電解裝置中箭頭表示溶液中陰離子移動的方向,則左室為陰極室,右室為陽極室,A為電源的負極,B為電源的陽極,陽極以稀硫酸為電解液,溶液中氫氧根離子放電生成氧氣,電極反應為:4OH--4e-=2H2O+O2↑,
故答案為:負極;4OH--4e-=2H2O+O2↑;
②Mn2+進入陽極區,發生氧化反應生成MnO2,需要有水參與反應,根據電荷守恒可知有氫離子生成,該副反應的電極反應式:Mn2++2H2O-2e-=MnO2+4H+,
故答案為:Mn2++2H2O-2e-=MnO2+4H+.
點評 本題考查學生對工藝流程的理解、閱讀題目獲取信息能力、物質的分離提純、化學平衡移動、電解原理等,綜合性較大,難度中等,需要學生具備扎實的基礎知識與綜合運用知識、信息進行解決問題的能力.


 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案科目:高中化學 來源: 題型:選擇題
| A. | “沙塵暴”屬于一種自然現象,與人類活動無關 | |
| B. | 碳酸鋁是一種應用很廣的視頻添加劑,可大量添加到饅頭、面包、油條等食品中 | |
| C. | 利用垃圾發電能達到節能減排的目的 | |
| D. | 持續高溫天氣的出現與人類活動無關 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2SiO3的酸性比H2CO3的強 | |
| B. | Mg(OH)2的堿性比Be(OH)2的強 | |
| C. | HF、HCl、HBr、HI的熱穩定性依次增強 | |
| D. | 若M+和R2-的核外電子層結構相同,則原子序數:R>M |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 自從英國化學家巴特列(N.Bartlett)首次合成了第一種稀有氣體的化合物XePtF6以來,人們又相繼發現了氙的一系列化合物,如XeF2、XeF4等.巴特列為開拓稀有氣體化學作出了歷史性貢獻.
自從英國化學家巴特列(N.Bartlett)首次合成了第一種稀有氣體的化合物XePtF6以來,人們又相繼發現了氙的一系列化合物,如XeF2、XeF4等.巴特列為開拓稀有氣體化學作出了歷史性貢獻.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶質的電離方程式為NaHCO3=Na++H++CO32- | |
| B. | 加水稀釋后,n(H+)與n(OH-)的乘積變大 | |
| C. | 離子濃度關系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 溫度升高,c(HCO3-)增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強堿性的溶液中,Na+、S2-、[Al(OH)4]-、SO32- | |
| B. | 酸性溶液中,Fe2+、Na+、NO3-、SO42- | |
| C. | 能與鋁放出H2的溶液中、K+、Cu2+、NO3-、SO42- | |
| D. | 無色溶液中Ca2+、Cu2+、ClO-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CS2為V形 | B. | HCN為V形 | ||
| C. | NH${\;}_{4}^{+}$為正四面體形 | D. | PCl3為平面三角形 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com