
 金屬鎳及其化合物在合金材料以及催化劑等方面應用廣泛.
金屬鎳及其化合物在合金材料以及催化劑等方面應用廣泛. 、④HCHO,其中碳原子采取sp2雜化的分子有①③④(填物質序號),HCHO分子的立體結構為平面三角形.
、④HCHO,其中碳原子采取sp2雜化的分子有①③④(填物質序號),HCHO分子的立體結構為平面三角形.分析 (1)Ni是28號元素,根據能量最低原則、泡利不相容原理和洪特規則,寫出其核外電子排布式為:1s22s22p43s23p43d84s2,據此判斷其外圍電子排布式;
(2)根據等電子體中原子數相同、價電子數相同分析;
(3)根據碳原子含有的σ鍵和孤電子對判斷碳原子采取的雜化方式; 根據價層電子對互斥理論判斷甲醛的空間構型;
(4)離子晶體熔沸點與晶格能成正比,晶格能與離子半徑成反比,與離子所帶電荷成正比;
(5)該晶胞中La原子個數=8×$\frac{1}{8}$=1,Ni原子個數=1+8×$\frac{1}{2}$=5,據此確定化學式.
解答 解:(1)Ni是28號元素,其核外電子排布式為:1s22s22p43s23p43d84s2,價電子數為10,價電子排布式為3d84s2,故答案為:3d84s2;
(2)CO含有2個原子14個電子,所以CO互為等電子體的一種分子和一種離子的化學式為:N2、CN-(或O22+、C22-、NO+),故答案為:N2;CN-;
(3)①CH2=CH2中每個碳原子含有3個σ鍵,不含孤電子對,所以采取sp2雜化,故正確;
②HC≡CH中每個碳原子含有2個σ鍵,不含孤電子對,所以采取sp雜化,故錯誤;
③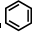 中每個碳原子含有3個σ鍵,不含孤電子對,所以采取sp2雜化,故正確;
中每個碳原子含有3個σ鍵,不含孤電子對,所以采取sp2雜化,故正確;
④HCHO中碳原子含有3個σ鍵,不含孤電子對,所以采取sp2雜化,故正確;
HCHO中碳原子含有3個σ鍵,不含孤電子對,所以其空間構型是平面三角形;
故答案為:①③④; 平面三角;
(4)離子晶體熔沸點與晶格能成正比,晶格能與離子半徑成反比,與離子所帶電荷成正比,Ni2+和Fe2+的半徑分別為69pm和78pm,則Ni2+半徑小于Fe2+的半徑,兩種晶體中陰陽離子所帶電荷都相同,所以晶格能NiO>FeO,所以熔點NiO>FeO,故答案為:>;
(5)該晶胞中La原子個數=8×$\frac{1}{8}$=1,Ni原子個數=1+8×$\frac{1}{2}$=5該晶胞中La、Ni原子個數之比為1:5,所以化學式為LaNi5或Ni5La,故答案為:LaNi5或Ni5La.
點評 本題考查了價電子的排布式、原子雜化方式判斷、晶胞計算及晶體熔沸點大小比較等知識點,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 非金屬氧化物肯定是酸性氧化物 | |
| B. | 堿性氧化物肯定是金屬氧化物 | |
| C. | 金屬氧化物都是堿性氧化物 | |
| D. | 不能跟酸反應的氧化物一定能跟堿反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | AB線表示Al3+的物質的量的變化 | B. | OC表示AlO2-的物質的量的變化 | ||
| C. | CD線表示Al(OH)3的物質的量的變化 | D. | BE線表示AlO2-的物質的量的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 元素 | 結構或性質信息 |
| X | 原子的L層上s電子數等于p電子數. |
| Y | 原子核外的L層有3個未成對電子. |
| Z | 在元素周期表的各元素中電負性僅小于氟. |
| Q | 單質常溫、常壓下是氣體,原子的M層上有1個未成對的p電子. |
| R | 核電荷數是Y與Q的核電荷數之和 |
| E | 原子序數比R大3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題





查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com