
| A. | 鐵、鋁在常溫下都能被濃硫酸“鈍化” | |
| B. | 足量鋁分別與含1molHCl、l mol NaOH的溶液反應,產生相同量的氫氣 | |
| C. | 鐵在純氧中燃燒或高溫下和水蒸氣反應均能得到Fe3O4 | |
| D. | 濃硫酸與銅反應既體現了其強氧化性又體現了其酸性 |
分析 A、鐵和鋁在常溫下,在濃硫酸和濃硝酸中發生鈍化,阻止反應進行;
B、依據鋁和酸、堿反應的定量關系計算分析;
C、鐵在純凈氧氣中燃燒生成四氧化三鐵,鐵和水蒸氣反應生成四氧化三鐵和氫氣;
D、濃硫酸和銅反應生成硫酸銅表現了硫酸的酸性,生成二氧化硫表現了濃硫酸的氧化性.
解答 解:A、鐵和鋁在常溫下,在濃硫酸和濃硝酸中發生鈍化,表面形成一層致密的氧化物薄膜阻止反應進行,故A正確;
B、依據鋁和酸、堿反應的定量關系計算分析,2Al+6H+=2Al3++3H2↑,2Al+2OH-+2H2O=2AlO2-+3H2↑,與1molHCl、l mol NaOH的溶液反應,分別生成氫氣0.5mol、1.5mol,產生相氫氣量不同,故B錯誤;
C、鐵在純凈氧氣中燃燒生成四氧化三鐵,鐵和水蒸氣反應生成四氧化三鐵和氫氣,鐵在純氧中燃燒或高溫下和水蒸氣反應均能得到Fe3O4,故C正確;
D、硫酸中元素化合價不變的表現酸性,硫元素化合價變化的表現氧化性,濃硫酸和銅反應生成硫酸銅表現了硫酸的酸性,生成二氧化硫表現了濃硫酸的氧化性,故D正確;
故選B.
點評 本題考查了金屬及其性質的理解應用,主要是鐵、鋁的性質分析,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | HCl、純堿、硫酸鋇均為強電解質 | |
| B. | SO2、SiO2、CO均為酸性氧化物 | |
| C. | 稀豆漿、油水、氯化鐵溶液均為膠體 | |
| D. | 大理石、CuSO4•5H2O、氨水均為混合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | 有關性質或結構信息 |
| A | 地殼中含量最多的元素 |
| B | B陽離子與A離子電子數相同,且是所在周期中單核離子半徑最小的 |
| C | C與B同周期,且是所在周期中原子半徑最大的(稀有氣體除外) |
| D | D單質是制造黑火藥的一種成分,也可用于殺菌消毒 |
| E | E與D同周期,且在該周期中原子半徑最小 |
| F | F的氫化物和最高價氧化物的水化物反應生成一種離子化合物 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為防止水污染,可用O3替代Cl2作飲用水消毒劑 | |
| B. | 實驗室可用濃硫酸干燥SO2氣體 | |
| C. | 16O和18O能形成三種化學性質相同的氧分子 | |
| D. | Al2(SO4)3,可除去堿性廢水及酸性廢水中的懸浮顆粒 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
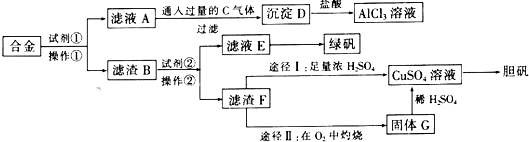
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl、BaCl2、AgNO3 | B. | AgNO3、HNO3、Ba(NO3)2 | ||
| C. | HNO3、Ba(NO3)2、AgNO3 | D. | AgNO3、HC1、BaC12 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | N2(g)+3H2(g)?2NH3(g)△H1<0 | B. | 2SO3(g)?2SO2(g)+O2(g)△H2>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H3<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H4>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com