
| A. | 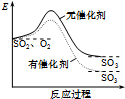 如圖表示SO2氧化反應分別在有、無催化劑的情況下反應過程中的能量變化 | |
| B. | 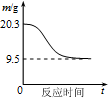 如圖表示0.1 mol MgCl2•6H2O在空氣中充分加熱時固體質量隨時間的變化 | |
| C. | 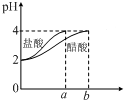 如圖表示分別稀釋10 mL pH=2的鹽酸和醋酸時溶液pH的變化,圖中b>100 | |
| D. | 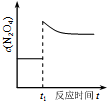 如圖表示平衡2NO2(g)?N2O4(g)在t1時迅速將體積縮小后c(N2O4)的變化 |
分析 A、催化劑只能改變化學反應中的活化能,不能改變熱效應;
B、MgCl2為強酸弱堿鹽,在空氣中加熱發生水解生成氧化鎂,據此解答即可;
C、醋酸是弱電解質,在水溶液里存在電離平衡,加水稀釋促進醋酸電離;
D、此反應特點為氣體體積減小的反應,縮小體積,即增大壓強,平衡右移.
解答 解:A、此圖中反應物總能量與生成物總能量差值出現變化,不可能是由于催化劑引起,催化劑不能改變反應的熱效應,故A錯誤;
B、MgCl2為強酸弱堿鹽,在空氣中加熱發生水解生成氧化鎂,0.1molMgO的質量為0.1mol×(24+16)g/mol=4.0g,故最終生成質量應為4.0g,故B錯誤;
C、醋酸是弱電解質,在水溶液里存在電離平衡,加水稀釋促進醋酸電離,氯化氫是強電解質,完全電離,導致稀釋過程中,醋酸中氫離子濃度大于鹽酸,所以pH變化小的為醋酸,且稀釋至pH=4,b應>100,故C正確;
D、此反應特點為氣體體積減小的反應,縮小體積,即增大壓強,平衡右移,c(N2O4)變大,與圖象中先變大后變小不一致,故D錯誤,
故選C.
點評 本題主要考查的是化學反應的能量變化規律、弱電解質的電離、平衡移動方向判斷等,綜合性較強,難度較大.


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:選擇題
| A. | 僅①③④ | B. | 僅②③④ | C. | 僅①③④⑤ | D. | 僅①②④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 室溫下,在水中的溶解度:丙烷>乙二醇>乙醇 | |
| B. | 可用碘水和銀氨溶液鑒別葡萄糖、麥芽糖和淀粉三種物質 | |
| C. | 油脂和蛋白質均為能發生水解反應的高分子化合物 | |
| D. | 聚碳酸酯 中含有 中含有 結構 結構 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHSO4溶液中,c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 室溫時水電離出來的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量共存 | |
| C. | 等物質的量濃度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小關系為:②>④>③>① | |
| D. | 在明礬溶液中加入氫氧化鋇溶液至沉淀的質量達到最大值時發生反應的離子方程式:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硫酸具有脫水性,可用于干燥CO2 | |
| B. | 氨氣具有還原性,可用于檢查HCl泄漏 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | 氧化鋁具有高熔點,可用于生產耐火磚 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,反應類型為加聚反應.
,反應類型為加聚反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
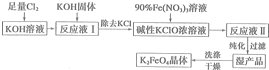

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com