
| A. | 同溫同壓同體積的CO2和SO2所含氧原子數均為2NA | |
| B. | 25℃時,pH=13的1.0L Ba(OH)2溶液中含有的OH-數目為0.1NA | |
| C. | 0.10molFe粉與足量水蒸氣反應生成的H2分子數為0.10NA | |
| D. | 1L1.0mol•L-1NH4Cl與2L 0.5mol•L-1NH4Cl溶液含NH4+數目相同 |
分析 A.沒有告訴二氧化碳和二氧化硫的物質的量,無法計算二者含有的氧原子數目;
B.常溫下pH=13的溶液中氫氧根離子濃度為0.1mol/L,根據n=cV計算出該溶液中含有的氫氧根離子數目;
C.根據鐵與水蒸氣反應的化學方程式3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2計算;
D.銨根離子濃度不同,在溶液中的水解程度不同.
解答 解:A.題中數據無法計算CO2和SO2的物質的量,則無法計算含有的氧原子數目,故A錯誤;
B.25℃時,pH=13的1.0L Ba(OH)2溶液中,氫氧根離子濃度為0.1mol/L,1L該溶液中含有0.1mol氫氧根離子,含有的OH-數目為0.1NA,故B正確;
C.Fe粉與足量水蒸氣反應的化學方程式為:3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2,所以0.10molFe粉與足量水蒸氣反應生成的H2分子數為:$\frac{0.4}{3}$NA,故C錯誤;
D.1L 1.0mol•L-1NH4Cl與2L 0.5mol•L-1NH4Cl溶液含溶質氯化銨的物質的量都是1mol,由于兩溶液中銨根離子的濃度不同,則銨根離子的水解程度不同,所以兩溶液中含有的NH4+數目不同,故D錯誤;
故選B.
點評 本題考查阿伏加德羅常數的有關計算和判斷,題目難度中等,注意掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,準確弄清分子、原子、原子核內質子中子及核外電子的構成關系,A為易錯點,注意題中條件無法計算二氧化碳和二氧化硫的物質的量.


科目:高中化學 來源: 題型:選擇題
 電化學降解NO3-的原理如圖所示,若電解過程中轉移了2mol電子,則膜兩側電解液的質量變化差(△m左-△m右)為a克,則a值為( )
電化學降解NO3-的原理如圖所示,若電解過程中轉移了2mol電子,則膜兩側電解液的質量變化差(△m左-△m右)為a克,則a值為( )| A. | 14.4 | B. | 10.4 | C. | 12.4 | D. | 14.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaBr+H2O.
+NaBr+H2O. .
. 為原料制備
為原料制備 的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 H、C、N、F、Al、Ca、Ni、Cu是中學階段常見的元素,回答下面幾個小題
H、C、N、F、Al、Ca、Ni、Cu是中學階段常見的元素,回答下面幾個小題查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
; ;該產物中核磁共振氫譜峰面積(由小到大)之比為1:3:4.
;該產物中核磁共振氫譜峰面積(由小到大)之比為1:3:4.
 ;
; .
.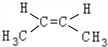 、
、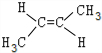 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+ Fe3+ ClO-Cl- | B. | H+ SO32-Fe2+ NO3- | ||
| C. | Ag+ K+ Cl-SO42- | D. | K+ NH4+Cl- CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
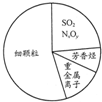
| A. | 燃燒反應的發生一定要用火去引燃 | |
| B. | 右圖為霧霾的主要成分示意圖,其中SO2和NxOy都屬于酸性氧化物,重金屬離子可導致蛋白質變性 | |
| C. | 塑料、合成橡膠和合成纖維是我們熟悉的三大合成材料,它們都是以石油、煤和天然氣為原料生產的 | |
| D. | 化肥的使用有效地提高了農作物的產量,常見的氮肥可分為銨態氮肥和硝態氮肥,硝酸鹽和尿素都屬于硝態氮肥 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示,把鋅片和銅片用導線相連后插入稀硫酸溶液中構成原電池,電子移動方向如圖中所標.下列敘述錯誤的是( )
如圖所示,把鋅片和銅片用導線相連后插入稀硫酸溶液中構成原電池,電子移動方向如圖中所標.下列敘述錯誤的是( )| A. | a為正極是金屬銅,b為負極是金屬鋅 | |
| B. | a極上H+得到電子,發生氧化反應 | |
| C. | b極金屬發生反應(或稱被腐蝕),發生氧化反應 | |
| D. | 該裝置將化學能轉變為電能 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com