

分析 (1)比較反應速率的大小可通過生成氣泡的快慢來判斷,比較金屬陽離子的催化效果要排斥陰離子的干擾;
(2)收集的氣體的體積相同,若比較反應速率快慢,需要知道生成40mL氣體所需的時間;
(3)①根據圖象確定生成氧氣的體積;
②根據圖象確定反應需要的時間;
③根據氧氣的量計算雙氧水的物質的量,再根據c=$\frac{n}{V}$計算雙氧水的物質的量濃度;
④根據v=$\frac{△c}{△t}$比較A、B、C、D各點反應速率快慢;
⑤物質的濃度與反應速率成正比,濃度減小,反應速率減小.
解答 解:(1)如圖甲可通過觀察產生氣泡的快慢,定性比較得出催化劑的催化效果;催化劑能改變化學反應的速率,這里是加快速率,若圖1所示實驗中反應速率為①>②,則一定說明氯化鐵比硫酸銅催化效果好,因二者所含的陰離子不同,要證明Fe3+比Cu2+對H2O2分解催化效果好,還要使選擇的試劑中陰離子種類相同,所以得出Fe3+和Cu2+對H2O2分解的催化效果,所以其結論不合理,
故答案為:產生氣泡的快慢;不合理; 陰離子種類不同;
(2)如圖乙所示,實驗時均以生成40mL氣體為準,其它可能影響實驗的因素均已忽略,如果比較反應速率快慢,則實驗中需要測量的數據為:產生40mL氣體所需的時間,反應時間越短,則反應速率越快,
故答案為:產生40mL氣體所需的時間;
(3)①根據圖象知,第4分鐘時,隨著時間的推移,氣體體積不變,所以實驗時放出氣體的總體積是60 mL,故答案為:60;
②放出 $\frac{1}{3}$氣體體積是60 mL×$\frac{1}{2}$=20mL,根據圖象知,需要的時間是1min,故答案為:1;
③設雙氧水的物質的量為x,
2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2mol 22.4L
x 0.06L
x=$\frac{2mol×0.06L}{22.4L}$=0.0054mol,
所以其物質的量濃度=$\frac{0.0054mol}{0.05L}$=0.11 mol•L-1,
故答案為:0.11 mol•L-1;
④根據圖象結合v=$\frac{△c}{△t}$知,A、B、C、D各點反應速率快慢的順序為:D>C>B>A,
故答案為:D>C>B>A;
⑤反應速率與反應物濃度成正比,隨著反應的進行,反應物濃度逐漸降低,反應速率逐漸減小,
故答案為:隨著反應的進行,濃度減小,反應速率減慢.
點評 本題考查探究催化劑、濃度等對反應速率的影響的實驗方案設計,試題涉及的題量稍大,根據v=$\frac{△c}{△t}$來設計實驗,通過得到氣體的體積和時間的關系確定影響反應速率的因素,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
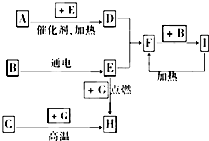 下列是中學化學中常見物質間的反應轉化關系圖,其中部分產物已略去,常溫下,G為固體單質,B、I為液體,其余都為氣體.A為化合物,I的濃溶液與G在加熱條件下生成F、B和C. H可用作工業上冶煉金屬的還原劑.請按要求填空:
下列是中學化學中常見物質間的反應轉化關系圖,其中部分產物已略去,常溫下,G為固體單質,B、I為液體,其余都為氣體.A為化合物,I的濃溶液與G在加熱條件下生成F、B和C. H可用作工業上冶煉金屬的還原劑.請按要求填空:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| NaCl | MgCl2 | CaCl2 | SiCl4 | |
| 熔點(℃) | 801 | 712 | 782 | -68 |
| 沸點(℃) | 1 465 | 1 412 | 1 600 | 57.6 |
| A. | 僅① | B. | 僅② | C. | ①②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
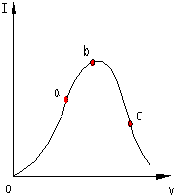 在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力I隨加入水的體積V變化的曲線如圖所示.請回答:
在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力I隨加入水的體積V變化的曲線如圖所示.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 金屬及其化合物有廣泛的應用.
金屬及其化合物有廣泛的應用.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com