
 金屬及其化合物有廣泛的應用.
金屬及其化合物有廣泛的應用.分析 (1)①先根據MgCl2的物質的量濃度=鎂離子濃度來計算濃度,再根據n=cV計算;
②根據稀釋前后溶質的物質的量不變,利用C=$\frac{n}{V}$來解答;
(2)發生CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+,n(Cu0)=$\frac{8.0g}{80g/mol}$=0.1mol,n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,結合反應及c=$\frac{n}{V}$來計算;
(3)該反應中Cl元素化合價由+5價變為0價、-1價變為0價,得電子化合價降低的反應物是氧化劑、失電子化合價升高的反應物是還原劑;
根據原子守恒計算被氧化的濃鹽酸物質的量;根據氯氣和轉移電子關系計算轉移電子數.
解答 解:(1)①根據MgCl2的物質的量濃度=鎂離子濃度=0.5 mol•L-1,MgCl2的物質的量=0.5 mol•L-1×0.2L=0.1mol,故答案為:0.1mol;
②溶液中的電荷守恒:c(Na+)×1+c(Mg2+)×2+c(Ca2+)×2=c(Cl-)×1,1.0 mol•L-1 +0.5 mol•L-1×2+c(Ca2+)×2=3 mol•L-1×1,c(Ca2+)=0.5 mol•L-1,c(CaCl2)=0.5 mol•L-1,稀釋后溶液中Ca2+的物質的量濃度為$\frac{0.5mol/L×0.2L}{1L}$=0.1 mol•L-1,故答案為:0.1 mol•L-1;
(2)n(Cu0)=)=$\frac{8.0g}{80g/mol}$=0.1mol,n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
發生CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+,
則Fe+2H+=H2↑+Fe2+,
0.2mol 0.1mol
CuO+2H+=H2O+Cu2+,
0.1mol 0.2mol
所所以n(HCl)=0.2mol+0.2mol=0.4mol,
c(HCl)=$\frac{0.4mol}{2L}$=0.2mol•L-1,
故答案為:CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+;0.2mol•L-1;
(3)該反應中Cl元素化合價由+5價變為0價、-1價變為0價,得電子化合價降低的反應物是氧化劑,所以氧化劑是KClO3;
因HCl中Cl元素的化合價升高,則HCl為該反應中的還原劑,該反應中只有Cl元素的化合價變化,氯氣既是氧化產物也是還原產物,由Cl原子守恒及電子守恒可知,5個Cl原子被氧化,1個Cl被還原,該反應中生成3molCl2轉移5mole-,當反應中6molCl2生成時,反應過程轉移電子的物質的量是5×2=10mol,有10mol HCl被氧化;
故答案為:KClO3;10mol;10.
點評 本題主要考查了溶液濃度、物質量的計算、鐵的化學性質及利用反應的計算以及氧化還原反應的分析計算,側重分析、計算能力的考查,題目難度不大.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,11.2 L氧氣含有的分子數目為nA | |
| B. | 1 mol H2所含有的電子數目為nA | |
| C. | 4.4 g 二氧化碳含有的分子數目為0.1 nA | |
| D. | 1 mol/L CaCl2溶液中含有的氯離子數目為2nA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
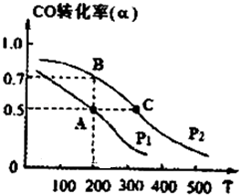 工業上一般以CO和H2為原料合成甲醇,該反應的熱化學方程式為:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工業上一般以CO和H2為原料合成甲醇,該反應的熱化學方程式為:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:解答題
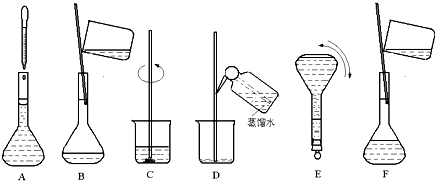
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 1 | 將X與Y用導線連接,浸入電解質溶液中,Y極上有氣泡產生 |
| 2 | 將片狀X、W分別投入等濃度的稀鹽酸中都有氣體產生,W比X反應劇烈 |
| 3 | 用惰性電極電解等物質的量濃度的Y和Z的硝酸鹽混合溶液,在陰極上首先析出Z |
| A. | 上述四種金屬中,Z的單質還原性最弱 | |
| B. | w的還原性強于Y的還原性 | |
| C. | Z放人CuSO4溶液中一定有Cu析出 | |
| D. | 用X、Z和稀硫酸可構成原電池,X作負極 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
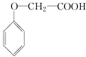 發生化學反應的產物.
發生化學反應的產物. 、
、 等.
等.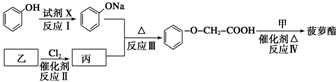
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ①②③④⑦ | C. | ①②④⑦ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com