
分析 (1)0.1mol•L-1CH3COONa溶液中醋酸根離子水解溶液顯堿性,醋酸根離子水解生成醋酸和氫氧根離子;
(2)碳酸鈉為強堿弱酸鹽,在溶液中存在水解平衡,從平衡移動的角度分析并解答該題;
(3)NaHCO3與Al2(SO4)3發生相互促進的水解反應生成二氧化碳和氫氧化鋁;
(4)0.1mol•L-1NaHCO3溶液的pH大于8,說明碳酸氫根離子的水解程度大于電離程度;
(5)ZnCl2•xH2O易溶于水,且其水溶液呈酸性,氯化鋅水解生成氫氧化鋅和鹽酸,溶液顯酸性,SOCl2極易與水發生生成二氧化硫和鹽酸,其中鹽酸起到抑制氯化鋅的水解,晶體和SOCl2混合加熱,結晶水失去和SOCl2極易和水反應生成鹽酸和二氧化硫.
解答 解:(1)0.1mol•L-1CH3COONa溶液中醋酸根離子水解溶液顯堿性,醋酸根離子水解生成醋酸和氫氧根離子,反應的離子方程式:CH3COO-+H2O=CH3COOH+OH-,
故答案為:堿,CH3COO-+H2O=CH3COOH+OH-;
(2)碳酸鈉為強堿弱酸鹽,在溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,為了防止發生水解,可以加入少量NaOH或NaHCO3,使平衡向逆反應方向移動,從而抑制水解,
故答案為:NaOH (或NaHCO3);
(3)NaHCO3與Al2(SO4)3發生相互促進的水解反應生成二氧化碳和氫氧化鋁,其反應的離子方程式為:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案為:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)常溫下,0.1mol•L-1NaHCO3溶液中存在電離和水解,離子方程式為:HCO3-?CO32-+H+、HCO3-+H20?H2CO3+OH-,的pH大于8,c(OH-)>c(H+),說明HCO3-水解程度大于其電離程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),
故答案為:>;HCO3-?CO32-+H+、HCO3-+H20?H2CO3+OH-,HCO3-的水解程度大于電離程度;
(5)ZnCl2•xH2O易溶于水,且其水溶液呈酸性,氯化鋅水解生成氫氧化鋅和鹽酸,溶液顯酸性,SOCl2極易與水發生生成二氧化硫和鹽酸,其中鹽酸起到抑制氯化鋅的水解,晶體和SOCl2混合加熱,反應的化學方程式為:ZnCl2•XH2O+XSOCl2 $\frac{\underline{\;\;△\;\;}}{\;}$ZnCl2+XSO2+2XHCl,結晶水失去和SOCl2極易和水反應生成鹽酸和二氧化硫,
SOCl2的作用是奪取ZnCl2•XH2O中的結晶水,生成的HCl抑制ZnCl2•XH2O的水解,
故答案為:ZnCl2•XH2O+XSOCl2 $\frac{\underline{\;\;△\;\;}}{\;}$ZnCl2+XSO2+2XHCl;奪取ZnCl2•XH2O中的結晶水,生成的HCl抑制ZnCl2•XH2O的水解.
點評 本題考查了鹽類水解的原理分析判斷,溶液酸堿性比較,弱離子的性質應用,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
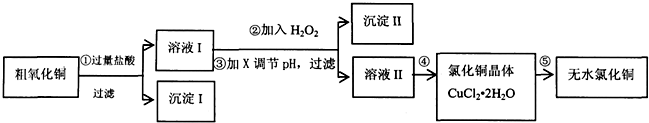
| 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
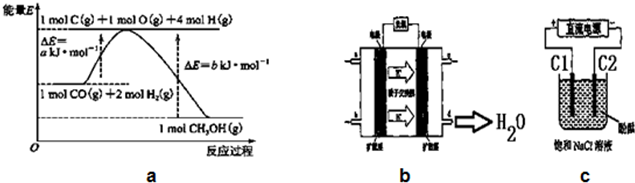
| 時間濃度(mol/L)溫度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗步驟 | 現象 | 結論 |
| ①分別取等體積的 2 mol/L的硫酸于試管 | 反應速率:鎂>鐵,銅不反應 | 金屬的性質越活潑,反應速率越快 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com