
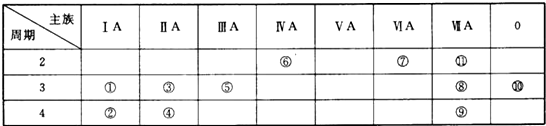

分析 由元素在周期表中位置,可知①為Na、②為K、③為Mg、④為Ca、⑤為Al、⑥為C、⑦為N、⑧為Cl、⑨為Br、⑩為Ar、⑾為F,
(1)稀有氣體化學性質最不活潑;該11種元素中,非金屬性最強的為F,其次為Cl,由于F沒有正化合價,則酸性最強的化合物為高氯酸;元素⑥與⑦形成的化合物為(CN)2,其分子中含有兩個C≡N和1個C-N鍵,據此寫出其電子式;
(2)⑧為Cl、⑨為Br,非金屬性越強,對應單質的活潑性越強;用鹵素單質的相互置換反應,可以證明鹵素單質的活潑性;
(3)離子的電子層越多,離子半徑越大,電子層相同時,核電荷數越多,離子半徑越小;
(4)元素⑧的氫化物為HCl,⑧的單質為氯氣,寫出濃鹽酸與二氧化錳反應生成氯氣的化學方程式;
(5)根據質量守恒定律判斷另一種產物為氧化鋁,然后寫出反應的化學方程式.
解答 解:由元素在周期表中位置,可知①為Na、②為K、③為Mg、④為Ca、⑤為Al、⑥為C、⑦為N、⑧為Cl、⑨為Br、⑩為Ar、⑾為F,
(1)稀有氣體Ar化學性質最不活潑;由于F沒有最高正價,則最高價氧化物對應水化物酸性最強的為高氯酸:HClO4;
C、N形成的化合物為氰氣,(CN)2結構為N≡C-C≡N,則其電子式為: ,
,
故答案為:Ar;HClO4; ;
;
(2)同主族自上而下非金屬性減弱,單質的氧化性減弱,故Br2的氧化性較弱,即氧化性Cl2>Br2,可以利用單質之間的相互置換反應證明,離子方程式為:Cl2+2Br-=2Cl-+Br2,
故答案為:Cl2;根據置換反應反應Cl2+2Br-=2Cl-+Br2可證明單質氧化性Cl2>Br2;
(3)②、③、⑧分別為K、Mg、Cl元素,對應離子為Cl-、K+、Mg2+,離子的電子層越多,離子半徑越大,則鎂離子的離子半徑最小;電子層相同時,核電荷數越大,離子半徑越小,則氯離子的離子半徑對應鉀離子,所以離子半徑大小為:Cl->K+>Mg2+,
故答案為:Cl->K+>Mg2+;
(4)⑧為Cl元素,其單質為氯氣,氫化物為HCl,實驗室中用濃鹽酸制取氯氣的化學方程式為:4HCl(濃)+MnO₂$\frac{\underline{\;\;△\;\;}}{\;}$MnCl₂+Cl₂↑+2H₂O,
故答案為:4HCl(濃)+MnO₂$\frac{\underline{\;\;△\;\;}}{\;}$MnCl₂+Cl₂↑+2H₂O;
(5)⑤的單質為Al,Al、石墨和二氧化鈦(TiO2)按比例混合,高溫下反應得到的兩種化合物均由兩種元素組成,且都是新型陶瓷材料(在火箭和導彈上有重要應用),則Al、C、TiO2在高溫下反應Al2O3和TiC,該反應方程式為:4Al+3C+3TiO2$\frac{\underline{\;高溫\;}}{\;}$2Al2O3+3TiC,
故答案為:4Al+3C+3TiO2$\frac{\underline{\;高溫\;}}{\;}$2Al2O3+3TiC.
點評 本題考查元素周期表和元素周期律的綜合應用,題目難度中等,熟悉元素周期表的結構及元素的推斷是解答本題的關鍵,并注重利用元素周期律、單質、化合物的性質、化學用語來解答即可.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖為制取乙酸乙酯的實驗裝置圖,請回答下列問題:
如圖為制取乙酸乙酯的實驗裝置圖,請回答下列問題:| 同一反應時間 | 同一反應溫度 | ||||
| 反應溫度/℃ | 轉化率(%) | 選擇性(%) | 反應時間/h | 轉化率(%) | 選擇性(%) |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.7 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:
50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 加碘食鹽中含有碘酸鉀(KIO3),現以電解法制備碘酸鉀,實驗裝置如圖所示.先將一定量的碘溶于過量氫氧化鉀溶液,發生反應:3I2+6KOH═5KI+KIO3+3H2O,將該溶液加入陽極區,另將氫氧化鉀溶液加入陰極區,開始電解.下列說法中正確的是( )
加碘食鹽中含有碘酸鉀(KIO3),現以電解法制備碘酸鉀,實驗裝置如圖所示.先將一定量的碘溶于過量氫氧化鉀溶液,發生反應:3I2+6KOH═5KI+KIO3+3H2O,將該溶液加入陽極區,另將氫氧化鉀溶液加入陰極區,開始電解.下列說法中正確的是( )| A. | 電解過程中OH-從a極區通過離子交換膜c進入b極區 | |
| B. | 隨著電解進行,KOH溶液濃度會逐漸減小 | |
| C. | 當陽極有0.1mol I-放電時,陰極生成6.72LH2 | |
| D. | a電極反應式:I--6e-+6OH-═IO3-+3H2O,a極區的KI最終轉變為KIO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{64m}{n}$ | B. | $\frac{32m}{n}$ | C. | $\frac{n}{32m}$ | D. | $\frac{n}{64m}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com