
【題目】NiCl2是化工合成中最重要的鎳源。工業上利用含鎳(Ni)廢催化劑(主要含有Ni,還含有SiO2、Al2O3、Fe及其它不溶于酸、堿的雜質)生產氯化鎳晶體(NiCl2·nH2O)流程如圖:
部分金屬氫氧化物Ksp近似值如下表所示:
化學式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列問題:
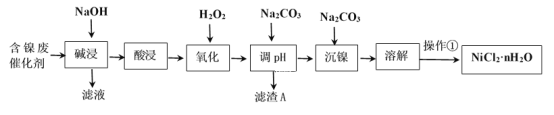
(1)Al的原子結構示意圖為___。
(2)“酸浸”、“溶解”所使用的酸為___。“堿浸”時發生反應的離子方程式為SiO2+2OH-=SiO32-+H2O、____。
(3)“氧化”加入H2O2溶液,其作用是___(用離子方程式表示)。然后調節pH使溶液中鐵元素恰好完全沉淀(離子濃度≤10-5mol·L-1時,離子沉淀完全),此時常溫下的pH約為____。
(4)“操作①”的實驗操作依次為緩緩加熱,濃縮至___為止、冷卻結晶、過濾、洗滌、干燥,即得產品。
(5)鎳氫電池已成為混合動力汽車的主要電池類型,其在堿性電解質溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M為儲氫合金)。寫出電池充電過程中陽極的電極反應式___。
MH+NiOOH(式中M為儲氫合金)。寫出電池充電過程中陽極的電極反應式___。
【答案】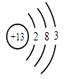 鹽酸 Al2O3+2OH-=2AlO2-+H2O 2Fe2++H2O2+2H+=2Fe3++2H2O 3 溶液表面出現結晶薄膜 Ni(OH)2+OH--e-=NiOOH+H2O
鹽酸 Al2O3+2OH-=2AlO2-+H2O 2Fe2++H2O2+2H+=2Fe3++2H2O 3 溶液表面出現結晶薄膜 Ni(OH)2+OH--e-=NiOOH+H2O
【解析】
某含鎳(Ni)廢催化劑中主要含有Ni,還含有SiO2、Al2O3、Fe及其它不溶于酸、堿的雜質,工藝流程的目的是用含鎳廢催化劑制備NiCl2nH2O晶體,分析工藝流程,將含Ni廢催化劑用NaOH溶液浸泡,SiO2和Al2O3溶于NaOH生成可溶于水的Na2SiO3和NaAlO2,進行過濾操作,所得濾渣為Fe、Ni及其他不溶于堿的雜質,再進行酸浸,則Fe和Ni溶于酸形成Fe2+和Ni2+,進行過濾操作,將不溶于酸的雜質被過濾出,濾液中主要含有Fe2+和Ni2+,用H2O2氧化溶液中的Fe2+生成Fe3+,再加入 Na2CO3溶液調節溶液pH,使Fe3+完全轉化為Fe(OH)3沉淀,過濾后濾液中再繼續滴加Na2CO3溶液生成Ni(OH)2沉淀,將過濾所得Ni(OH)2沉淀用鹽酸溶解,并蒸發濃縮、冷卻結晶、過濾即得NiCl2nH2O晶體,據此分析。
(1)Al的原子序數為13,位于元素周期表第三周期,即共有3個電子層,且最外層電子數為3,則其原子結構示意圖為 ,故答案為:
,故答案為: ;
;
(2)本工藝流程的目的是用含鎳廢催化劑制備NiCl2nH2O晶體,則“酸浸”、“溶解”所使用的酸為稀鹽酸;“堿浸”時SiO2和Al2O3溶于NaOH生成可溶于水的Na2SiO3和NaAlO2,發生反應的離子方程式為SiO2+2OH-=SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O,故答案為:鹽酸;Al2O3+2OH-=2AlO2-+H2O;
(3)因Fe3+更易形成Fe(OH)3達到去除Fe元素的目的,則加入H2O2溶液的目的是氧化Fe2+為Fe3+,發生的離子反應為2Fe2++H2O2+2H+=2Fe3++2H2O;調節pH使溶液中鐵元素恰好完全沉淀,定性分析來看,溶液中c(Fe3+)濃度低于10-5mol/L可認為Fe3+幾乎完全被除去,此時溶液中c(OH-)=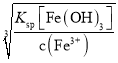 =10-11mol/L,則pH =14+lgc(OH-)=3,故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;3;
=10-11mol/L,則pH =14+lgc(OH-)=3,故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;3;
(4)“操作①”的目的為從溶液中獲得NiCl2nH2O晶體,操作依次為緩緩加熱,濃縮至溶液表面出現結晶薄膜為止、再經冷卻結晶、過濾、洗滌、干燥,即得產品,故答案為:溶液表面出現結晶薄膜;
(5)鎳氫電池在堿性電解質溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH,充電時陽極上Ni(OH)2發生氧化反應,生成NiOOH,則陽極的電極反應式為Ni(OH)2+OH-- e-=NiOOH+H2O,故答案為:Ni(OH)2+OH--e-=NiOOH+H2O。
MH+NiOOH,充電時陽極上Ni(OH)2發生氧化反應,生成NiOOH,則陽極的電極反應式為Ni(OH)2+OH-- e-=NiOOH+H2O,故答案為:Ni(OH)2+OH--e-=NiOOH+H2O。


科目:高中化學 來源: 題型:
【題目】為了探究化學能與熱能的轉化,某實驗小組設計了如下三套實驗裝置:

(1)上述3個裝置中,不能證明“銅與濃硝酸反應是吸熱反應還是放熱反應”的是_______。(填“Ⅰ”“Ⅱ”或“Ⅲ”)
①M為鈉,則實驗過程中燒杯中可觀察到的現象是__________________;
②觀察到燒杯里產生氣泡,則說明M溶于水______(填“一定是放熱反應”“一定是吸熱反應”或“可能是放熱反應”),理由是_____________________________;
③若觀察到燒杯里的玻璃管內形成一段水柱,則M可能是_______________。
(2)某同學選用裝置Ⅰ進行實驗(實驗前U形管里液面左右相平),在甲試管里加入適量氫氧化鋇溶液與稀硫酸,U形管中可觀察到的現象是________________,說明該反應屬于______(填“吸熱”或“放熱”)反應。
(3)為探究固體M溶于水的熱量變化情況,選擇裝置Ⅱ進行實驗(在甲中進行)。M為鈉,則實驗過程中燒杯中可觀察到的現象是_________________;
(4)至少有兩種實驗方法能證明超氧化鉀與水的反應(4KO2+2H2O=4KOH+3O2↑)是放熱反應還是吸熱反應。
方法①:選擇上述裝置__________(填“Ⅰ”“Ⅱ”或“Ⅲ”)進行實驗;
方法②:取適量超氧化鉀粉末用脫脂棉包裹并放在石棉網上,向脫脂棉上滴加幾滴蒸餾水,片刻后,若觀察到棉花燃燒,則說明該反應是________反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解100mL含c(H+)=0.3mol/L的下列溶液,當電路中通過0.04mol電子時,理論上析出金屬質量最大的是( )
A. 0.10mol/LAg+B. 0.20mol/LZn2+C. 0.20mol/LCu2+D. 0.20mol/LPb2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知K、Ka、Kb、Kw、Kh、Ksp分別表示化學平衡常數、弱酸的電離平衡常數、弱堿的電離平衡常數、水的離子積常數、鹽的水解平衡常數、難溶電解質的溶度積常數。
(1)有關上述常數的說法正確的是______。
a.它們都能反映一定條件下對應變化進行的程度
b.它們的大小都隨溫度的升高而增大
c.常溫下,CH3COOH在水中的Ka大于在飽和CH3COONa溶液中的Ka
d.一定溫度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃時,將a mol·L-1的氨水與0.01 mol·L-1的鹽酸等體積混合所得溶液中c(NH4+)=c(Cl-),則溶液顯_____(填“酸”“堿”或“中”)性;用含a的代數式表示NH3·H2O的電離平衡常數Kb=____。
(3)高爐煉鐵中發生的反應有FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0。該反應的平衡常數表達式K=_____;已知1100 ℃時,K=0.25,則平衡時CO的轉化率為________;在該溫度下,若測得高爐中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,則此時反應速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
Fe(s)+CO2(g) ΔH<0。該反應的平衡常數表達式K=_____;已知1100 ℃時,K=0.25,則平衡時CO的轉化率為________;在該溫度下,若測得高爐中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,則此時反應速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
(4)已知高溫下Fe(OH)3和Mg(OH)2的Ksp分別為8.0×10-38、1.0×10-11,向濃度均為0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入堿液,要使Fe3+完全沉淀而Mg2+不沉淀,應該調節溶液pH的范圍是______(已知lg2=0.3)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用鄰苯二甲酸氫鉀,(分子式為![]() 相對分子質量為204)測定NaOH溶液的濃度,若NaOH溶液的濃度在0.1mol/L左右,滴定終點時溶液的pH約為9.1。
相對分子質量為204)測定NaOH溶液的濃度,若NaOH溶液的濃度在0.1mol/L左右,滴定終點時溶液的pH約為9.1。
(1)寫出鄰苯二甲酸氫鉀與NaOH反應的化學方程式:________。
(2)將用分析天平精確稱量的鄰苯二甲酸氫鉀放于錐形瓶中,加適量的水溶解,溶液無色,再加入指示劑_____(從甲基橙、酚酞、石蕊中選擇),用NaOH溶液滴定到終點時,現象是________。
(3)該實驗要用到的主要玻璃儀器_______、______。
(4)該學生進行三次實驗,所取固體的質量均相同,填寫下表:
實驗 編號 | 鄰苯二甲酸氫鉀的質量(g) | 待測NaOH溶液的體積(mL) |
1 | 0.4488 | 22.24 |
2 | 20.04 | |
3 | 19.96 |
滴定中誤差較大的是第_____次實驗,造成這種誤差的可能原因是_____
a.滴定時有NaOH溶液滴到錐形瓶外面;
b.未用NaOH溶液潤洗滴定管;
c.NaOH溶液在“0”刻度線以上,未予調整就開始滴定;
d.觀察記錄滴定管內液面刻度時滴定前仰視,滴定后俯視;
e.酚酞指示劑由無色變為紅色時立即停止滴定。
(5)NaOH溶液的物質的量濃度為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)元素的第一電離能:Al____Si(填“>”或“<”),按電負性由大到小的順序排列N、O、F___。
(2)基態Mn2+的核外電子排布式為___。
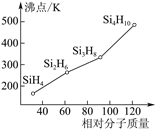
(3)硅烷(SinH2n+2)的沸點與其相對分子質量的變化關系如圖所示,呈現這種變化關系的原因是___。
(4)硼砂是含結晶水的四硼酸鈉,其陰離子Xm-(含B、O、H三種元素)的球棍模型如圖所示:
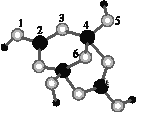
①在Xm-中,硼原子軌道的雜化類型有___;配位鍵存在于___原子之間(填原子的數字標號)。
②硼砂晶體由Na+、Xm-和H2O構成,它們之間存在的作用力有___(填序號)。
A.離子鍵 B.共價鍵 C.金屬鍵 D.范德華力E.氫鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電致變色玻璃以其優異的性能將成為市場的新寵。如圖所示為五層膜的玻璃電致變色系統,其工作原理是:在外接電源下,通過在膜材料內部發生氧化還原反應,實現對器件的光透過率進行多級可逆性調節。(已知:WO3和Li4Fe4[Fe(CN)6]3均為無色透明,LiWO3和Fe4[Fe(CN)6]3均為藍色)下列有關說法正確的是

A. 當B外接電源負極時,膜由無色變為藍色
B. 當B外接電源負極時,離子儲存層發生反應為:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 當A接電源的負極時,此時Li+得到電子被還原
D. 當A接電源正極時,膜的透射率降低,可以有效阻擋陽光
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:
Ⅰ.A是石油裂解氣的主要成分,A的產量通常是衡量一個國家石油化工水平的標準。
Ⅱ.2CH3CHO+O2→2CH3COOH。
現以A為主要原料合成乙酸乙酯,其合成路線如圖所示:
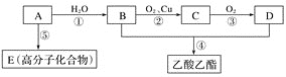
請回答下列問題。
(1)寫出A的結構簡式:___。
(2)B物質的名稱是___。
(3)E___(填“能或不能”)使酸性高錳酸鉀溶液褪色
(4)寫出下列反應方程式及反應類型:
②化學方程式__,反應類型___。
④化學方程式__,反應類型___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉、硫及其化合物用途非常廣泛。回答下列問題:
(1)基態S原子價層電子的軌道表達式為________,基態Na原子電子占據最高能級的電子云輪廓圖為________形。
(2)乙炔鈉廣泛用于有機合成,乙炔鈉中存在________(填序號)。乙炔鈉的熔沸點比S8高,原因是________。
A.金屬鍵 B.σ鍵 C.π鍵 D.氫鍵
(3)NaN3是用于汽車安全氣囊的產氣藥,N3—的空間構型為________,N3—中心原子的雜化方式是____________________。
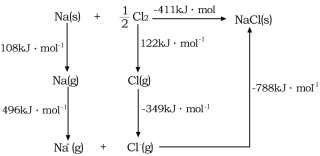
(4)![]() 的晶格能可通過圖示中的born—Haber循環計算得到,Na原子的電子電離能為________kJ·mol-1,Cl-Cl的鍵能為_______kJ·mol-1,Cl的電子親和能為_______kJ·mol-1,NaCl的晶格能為________kJ·mol-1。
的晶格能可通過圖示中的born—Haber循環計算得到,Na原子的電子電離能為________kJ·mol-1,Cl-Cl的鍵能為_______kJ·mol-1,Cl的電子親和能為_______kJ·mol-1,NaCl的晶格能為________kJ·mol-1。
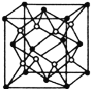
(5)已知![]() 的晶胞結構如圖所示,晶體密度為1.86g·cm-3。設NA為阿伏加德羅常數的數值,則晶胞參數a=________
的晶胞結構如圖所示,晶體密度為1.86g·cm-3。設NA為阿伏加德羅常數的數值,則晶胞參數a=________![]() (列出計算式)。
(列出計算式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com