
【題目】鈉、硫及其化合物用途非常廣泛。回答下列問題:
(1)基態S原子價層電子的軌道表達式為________,基態Na原子電子占據最高能級的電子云輪廓圖為________形。
(2)乙炔鈉廣泛用于有機合成,乙炔鈉中存在________(填序號)。乙炔鈉的熔沸點比S8高,原因是________。
A.金屬鍵 B.σ鍵 C.π鍵 D.氫鍵
(3)NaN3是用于汽車安全氣囊的產氣藥,N3—的空間構型為________,N3—中心原子的雜化方式是____________________。
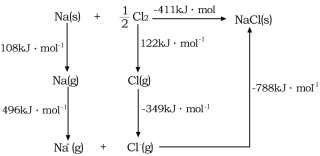
(4)![]() 的晶格能可通過圖示中的born—Haber循環計算得到,Na原子的電子電離能為________kJ·mol-1,Cl-Cl的鍵能為_______kJ·mol-1,Cl的電子親和能為_______kJ·mol-1,NaCl的晶格能為________kJ·mol-1。
的晶格能可通過圖示中的born—Haber循環計算得到,Na原子的電子電離能為________kJ·mol-1,Cl-Cl的鍵能為_______kJ·mol-1,Cl的電子親和能為_______kJ·mol-1,NaCl的晶格能為________kJ·mol-1。
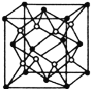
(5)已知![]() 的晶胞結構如圖所示,晶體密度為1.86g·cm-3。設NA為阿伏加德羅常數的數值,則晶胞參數a=________
的晶胞結構如圖所示,晶體密度為1.86g·cm-3。設NA為阿伏加德羅常數的數值,則晶胞參數a=________![]() (列出計算式)。
(列出計算式)。
【答案】![]() 球 BC 乙炔鈉是離子晶體,
球 BC 乙炔鈉是離子晶體,![]() 是分子晶體 直線形
是分子晶體 直線形 ![]()
![]()
![]() 349 788
349 788 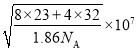
【解析】
(1)基態S原子是16號原子,它的價電子軌道表示式為![]() ;Na的最高能級為3s能級,電子云模型為球形;
;Na的最高能級為3s能級,電子云模型為球形;
(2)乙炔鈉是一種有機金屬化合物,結構中存在離子鍵、σ鍵和π鍵,乙炔鈉的熔沸點比S8高,原因是乙炔鈉是離子晶體,S8是分子晶體;
(3)根據VSEPR模型計算,中心原子不存在孤電子對,因此N3-為直線型分子,中心N原子的雜化方式為sp雜化;
(4)根據Born—Haber循環可以得到,Na原子的電子電離能為氣態基態電中性原子失去電子所吸收的能量為496 kJ·mol-1,Cl-Cl的鍵能為1molCl2斷開化學鍵所吸收的能量為244 kJ·mol-1,Cl的電子親和能為Cl-得到電子變成Cl所放出的能量為349 kJ·mol-1,NaCl的晶格能為Na+和Cl-形成穩定氧化物所放出的能量為788 kJ·mol-1;
(5)從晶胞結構中可以看出Na在晶胞的體心,S在晶胞的頂點和面心上,一個晶胞中4個Na2S,由此可以算出晶胞參數為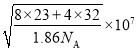 。
。


科目:高中化學 來源: 題型:
【題目】NiCl2是化工合成中最重要的鎳源。工業上利用含鎳(Ni)廢催化劑(主要含有Ni,還含有SiO2、Al2O3、Fe及其它不溶于酸、堿的雜質)生產氯化鎳晶體(NiCl2·nH2O)流程如圖:
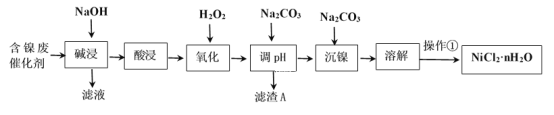
部分金屬氫氧化物Ksp近似值如下表所示:
化學式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列問題:
(1)Al的原子結構示意圖為___。
(2)“酸浸”、“溶解”所使用的酸為___。“堿浸”時發生反應的離子方程式為SiO2+2OH-=SiO32-+H2O、____。
(3)“氧化”加入H2O2溶液,其作用是___(用離子方程式表示)。然后調節pH使溶液中鐵元素恰好完全沉淀(離子濃度≤10-5mol·L-1時,離子沉淀完全),此時常溫下的pH約為____。
(4)“操作①”的實驗操作依次為緩緩加熱,濃縮至___為止、冷卻結晶、過濾、洗滌、干燥,即得產品。
(5)鎳氫電池已成為混合動力汽車的主要電池類型,其在堿性電解質溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M為儲氫合金)。寫出電池充電過程中陽極的電極反應式___。
MH+NiOOH(式中M為儲氫合金)。寫出電池充電過程中陽極的電極反應式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】足量銅與一定量濃硝酸反應,得到硝酸銅溶液和NO、NO2的混合氣體,這些氣體與1.68LO2(標準狀況下)混合后通入水中,所有氣體完全被水吸收生成硝酸。若向所得硝酸銅溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,則消耗溶液NaOH的體積是( )
A.60mLB.45mLC.30mLD.15mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高血脂嚴重影響人體徤康,化合物H是一種臨床治療高血脂癥的藥物。H的結構簡式如圖所示。
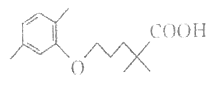
下列說法不正確的是( )
A. 有機物H含有的官能團只有羧基
B. 1mol H完全燃燒消耗19molO2
C. 有機物H是芳香化合物
D. 有機物H能和鈉、碳酸氫鈉反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、W是前四周期元素,原子序數依次增大,X元素原子最外層電子數是內層的2倍,Y的原子半徑是在同周期中最大;Z元素原子的最外層電子數比次外層電子數少2,M原子外圍電子排布式為3dn4sn;W的內層電子己全充滿,最外層只有2個電子。
請回答下列問題:
(1)Y元素在周期表中的位置是_________; W2+離子的價電子排布式為__________。
(2)X能與S、氮、氧二種元素構成化合物XO(NH2)2,其中X原子和N原子的雜化方式為分別為_____、____,該化合物分子中的π鍵與![]() 鍵的個數之比是____;該物質易溶于水的主要原因是____。
鍵的個數之比是____;該物質易溶于水的主要原因是____。
(3)己知Be和A1元素處于周期表中對角線位置,化學性質相似,請寫出Y元素的最高價氧化物對應水化物與Be相互反應的化學方程式:____________。
(4)M晶體的原子堆積如圖所示,則該晶體的堆積方式為________,晶體中M原子的配位數是_____。某M配合物的化學式是[M(H2O)5C1]Cl2·H2O,1mol該配合物中含配位鍵是_____mol。

(5)Y離子和Z離子比較,半徑較大的是__________(填離子符號)元素Y與元素Z形成了晶體的晶胞結構是如圖所示的正方體,每個Y離子周圍與它最接近的Y離子有__________個。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的甲烷燃燒產物為CO、CO2和水蒸氣,此混合氣體重49.6g,當其緩慢通過無水CaCl2時,CaCl2增重25.2g,則原混合氣體中CO的質量為( )
A.11.2gB.13.2gC.19.7gD.24.4g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關晶體的結構如圖所示,下列說法中不正確的是
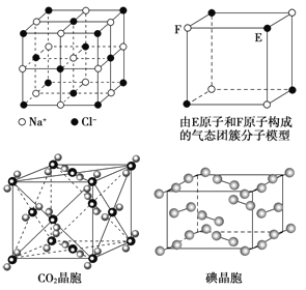
A. 在NaCl晶體中,距Na+最近的Cl-形成正八面體
B. 每個該氣態團簇分子的分子中含有1/2個E原子
C. 在CO2 晶體中,一個CO2 分子周圍有12個CO2 分子緊鄰
D. 在碘晶體中,碘分子的排列有兩種不同的方向
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質在給定條件下的同分異構體數目正確的是
A.C4H10屬于烷烴的同分異構體有3種
B.分子組成是C5H10O2屬于羧酸的同分異構體有5種
C.分子組成是C5H10O屬于醛的同分異構體有3種
D.![]() 的一溴代物有5種
的一溴代物有5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹽酸、硫酸和硝酸是中學階段常見的“三大酸”。現據“三大酸”與金屬銅反應的情況,回答下列問題:
(1)稀鹽酸不與Cu反應,若在稀鹽酸中加入H2O2(常見氧化劑,作氧化劑時還原產物為水)后,則可使銅順利溶解,該反應的離子方程式為_。
(2)在一定體積的18mol·L-1的濃硫酸中加入過量銅片,加熱使之反應,被還原的硫酸為0.9mol,則濃硫酸的實際體積__(填“大于”“等于”或“小于”)100mL。若使剩余的銅片繼續溶解,可向其中加入硝酸鹽溶液(如KNO3溶液),則該反應的離子方程式為__。
(3)根據如圖操作及現象推斷酸X為__(填序號)。

A.濃鹽酸 B.濃硫酸 C.濃硝酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com