
 文敬圖書課時先鋒系列答案
文敬圖書課時先鋒系列答案科目:高中化學 來源: 題型:解答題
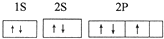
 四種常見元素的性質或結構信息如下表,試根據信息回答有關問題.
四種常見元素的性質或結構信息如下表,試根據信息回答有關問題.| 元素 | A | B | C | D |
| 性質 結構 信息 | 原子核外有兩個電子層,最外層有3個未成對的電子 | 原子的M層有1對成對的p電子 | 原子核外電子排布為[Ar]3d104sx, 有+1、+2兩種常見化合價 | 有兩種常見氧化物,其中有一種是冶金工業常用的還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 通入少量SO2,溶液漂白性增強 | |
| B. | 加入少量NaHCO3固體,c(ClO)減小 | |
| C. | 加入少量水,水的電離平衡向正方向移動 | |
| D. | 加入NaOH固體至恰好完全反應,一定有c(Na+)=c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 目的 | 裝置 | 原理 |
| A | 分離乙酸乙酯和乙醇 |  | 乙酸乙酯和乙醇的密度不同 |
| B | 實驗室制備氨氣 |  | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O |
| C | 證明非金屬性N>C>Si |  | 最高價含氧酸酸性:硝酸>碳酸>硅酸 |
| D | 除去丁醇中的乙醚 |  | 丁醇和乙醚的沸點不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
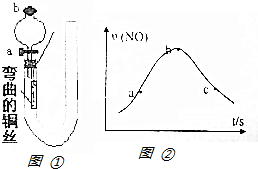 如圖①是某化學興趣小組同學設計的研究銅和稀硝酸反應速率[v(NO)]的實驗裝置圖.試回答下列問題:
如圖①是某化學興趣小組同學設計的研究銅和稀硝酸反應速率[v(NO)]的實驗裝置圖.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
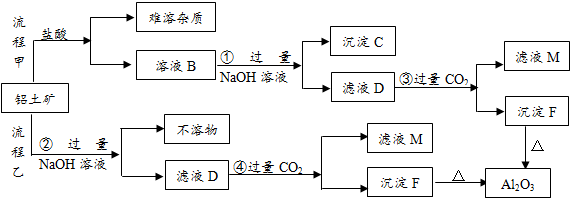
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
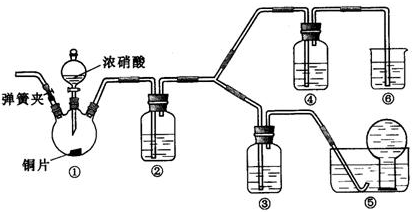
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.2 mol | B. | 1.5mol | C. | 3.0 mol | D. | 2.0 mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com