
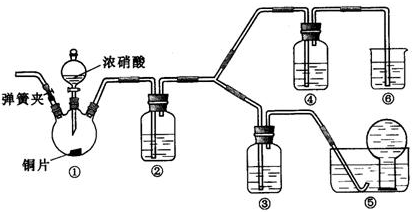
分析 (1)HNO3作氧化劑轉化的NO2是還原產物,NO作還原劑轉化的NO2是氧化產物,根據化合價升高和降低的價數相等計算;
(2)根據裝置特點和實驗目的,裝置⑤是收集NO,裝置⑥中盛放NaOH溶液吸收NO2,因為要驗證稀HNO3不能氧化NO,所以裝置③中應該盛放稀硝酸;
(3)由于裝置中殘存的空氣能氧化NO而對實驗產生干擾,需要先通入一段時間CO2趕走裝置中的空氣,同時也需將裝置⑤中導管末端伸入倒置的燒瓶內防止反應產生的NO氣體逸出;
(4)Cu與濃HNO3反應生成Cu(NO3)2、NO2、H2O,裝置②中盛放H2O,使NO2與H2O反應生成NO;
(5)根據液面上方是否有紅棕色NO2產生判斷;
(6)根據是否改變溶液中硝酸銅的質量分數或溶解氣體的濃度判斷.
解答 解:(1)HNO3作氧化劑轉化的NO2是還原產物,NO作還原劑轉化的NO2是氧化產物,根據化合價升高和降低的價數相等,則2n(氧化產物)=n(還原產物),所以氧化產物與還原產物的物質的量之比為1:2,
故答案為:1:2;
(2)根據裝置特點和實驗目的,裝置⑤是收集NO,裝置⑥中盛放NaOH溶液吸收NO2,因為要驗證稀HNO3不能氧化NO,所以裝置③中應該盛放稀硝酸,裝置④中盛放濃硫酸,
故答案為:3mol/L稀硝酸、濃硝酸、氫氧化鈉溶液;
(3)由于裝置中殘存的空氣能氧化NO而對實驗產生干擾,所以滴加濃HNO3之前需要通入一段時間CO2趕走裝置中的空氣,同時也需將裝置⑤中導管末端伸入倒置的燒瓶內防止反應產生的NO氣體逸出,
故答案為:通入CO2一段時間,關閉彈簧夾,將裝置⑤中導管末端伸入倒置的燒瓶內;
(4)裝置①中Cu與濃HNO3反應生成Cu(NO3)2、NO2、H2O,反應方程式為:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,裝置②中盛放H2O,使NO2與H2O反應生成NO,反應方程式為:3NO2+H2O═2HNO3+NO,
故答案為:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O;將NO2轉化為NO;3NO2+H2O═2HNO3+NO;
(5)NO通過稀HNO3溶液后,若無紅棕色NO2產生,說明稀HNO3不能氧化NO,所以盛放稀HNO3裝置的液面上方沒有顏色變化即可說明之,裝置④中盛放的是濃HNO3,若濃HNO3能氧化NO則裝置④液面的上方會產生紅棕色氣體,
故答案為:裝置③中液面上方氣體仍為無色,裝置④中液面上方氣體由無色變為紅棕色;
(6)要證明是Cu(NO3)2濃度過高或是溶解了NO2導致裝置①中溶液呈綠色,可設計將溶解的NO2趕走(a、c方案)再觀察顏色變化;也可在Cu(NO3)2的濃溶液中通入NO2進行比較觀察反應后的顏色變化(d方案),確定是否是因為溶有NO2引起的;方案b由于Cu(NO3)2和溶解在其中的NO2濃度均可發生變化,故無法確定是哪一種因素引起的,故acd正確,
故答案為:acd.
點評 本題考查物質性質探究實驗設計,利用對比的方法判斷硝酸的性質,題目難度中等,是對基礎知識與學生綜合能力的考查,理解原理與各裝置作用是解題的關鍵.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | 甲 | 乙 | 丙 |
| 樣品質量(g) | 9.6 | 12.8 | 64.0 |
| 氣體體積(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
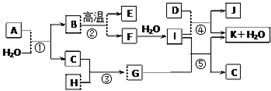 如圖所示各物質是由1~20號元素中部分元素組成的單質或其化合物,圖中部分反應條件未列出.已知C、H是無色有刺激性氣味的氣體,D是一種黃綠色的氣體單質,物質J可用于泳池消毒.反應②和④是化工生產中的重要反應,反應⑤是實驗室制備氣體C的重要方法.
如圖所示各物質是由1~20號元素中部分元素組成的單質或其化合物,圖中部分反應條件未列出.已知C、H是無色有刺激性氣味的氣體,D是一種黃綠色的氣體單質,物質J可用于泳池消毒.反應②和④是化工生產中的重要反應,反應⑤是實驗室制備氣體C的重要方法. ;I中所含化學鍵類型離子鍵、共價鍵.
;I中所含化學鍵類型離子鍵、共價鍵.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K=$\frac{[C]•[{H}_{2}O]}{[CO]•[{H}_{2}]}$ | B. | K=$\frac{[CO]•[{H}_{2}]}{[C]•[{H}_{2}O]}$ | C. | K=$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$ | D. | K=$\frac{[{H}_{2}O]}{[CO]•[{H}_{2}]}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com