

分析 (1)依據蓋斯定律和熱化學方程式計算得到;
(2)考慮影響反應速率的因素;
(3)①由圖1可知,溫度相同時,在壓強為P2時平衡時CO的轉化率高,由反應CO(g)+2H2(g)?CH3OH(g)可知壓強越大,越有利于平衡向正反應進行;
②由圖1可知,在P1壓強下,100℃時,CO的轉化率為0.5,據此計算CO的濃度變化量,根據三段式計算平衡時各組分的平衡濃度,計算合成甲醇的化學平衡常數;
③在其它條件不變的情況下,向容器中通入CO、H2、CH3OH各0.5amol,等效減小氫氣的濃度,平衡向逆反應移動;
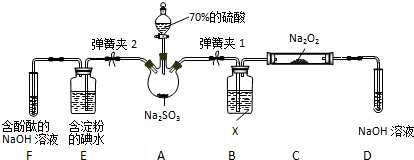
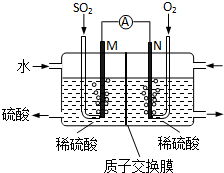
(4)反應原理為二氧化硫、氧氣和水反應生成硫酸,根據化合價變化判斷負極物質,寫出負極反應式;
②根據化合價變化判斷陽極反應物質,寫出陽極反應式;
(5)Na2SO3溶液的濃度為2×10-3mol/L,等體積混合后溶液中c(SO32-)=1×10-3mol/L,根據Ksp=c(SO32-)•c(Ca2+)計算沉淀時混合溶液中c(Ca2+),原溶液CaCl2溶液的最小濃度為混合溶液中c(Ca2+)的2倍;陽極是亞硫酸氫根氧化成硫酸根,而陰極是水中的氫離子放電生成氫氣,所以總的電解反應方程式為:2NaHSO3+H2O$\frac{\underline{\;電解\;}}{\;}$Na2SO3+H2SO4+H2↑.
解答 解:(1)用CO可以合成甲醇.已知:
①CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-764.5kJ•mol-1;
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
由蓋斯定律可知,②+③×2-①得到CO(g)+2H2(g)?CH3OH(g)
△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol,故答案為:-90.1;
(2)溫度越高、壓強越大,使用催化劑都可使反應速率增大,降低溫度反應速率減慢,從體系中分離出甲醇,相當于減少濃度,反應速率減慢,
故答案為:ac;
(3))①由圖1可知,溫度相同時,在壓強為P2時平衡時CO的轉化率高,由反應CO(g)+2H2(g)?CH3OH(g)可知壓強越大,
越有利于平衡向正反應進行,故壓強P1<P2,
故答案為:小于;
②由于平衡常數與壓強沒有關系,所以根據圖象可知,在100℃P1時,CO的轉化率是0.5,則
CO(g)+2H2(g)=CH3OH(g)
起始濃度(mol/L) $\frac{a}{V}$ $\frac{2a}{V}$ 0
轉化濃度(mol/L)$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
平衡濃度(mol/L)$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
所以平衡常數K=$\frac{\frac{a}{2V}}{(\frac{a}{V})^{2}×\frac{a}{2V}}$=$(\frac{V}{a})^{2}$,
故答案為:$(\frac{V}{a})^{2}$;
③在其它條件不變的情況下,向容器中通入CO、H2、CH3OH各0.5amol,等效減小氫氣的濃度,平衡向逆反應移動,
故答案為:向左;
(4))該原電池中,負極上失電子被氧化,二氧化硫到硫酸,硫的化合價升高,所以負極上投放的氣體是二氧化硫,二氧化硫失電子和水反應生成硫酸根離子和氫離子,所以負極上的電極反應式為:SO2-2e-+2H2O═SO42-+4H+,
故答案為:SO2-2e-+2H2O═SO42-+4H+;
(5)Na2SO3溶液的濃度為2×10-3mol/L,等體積混合后溶液中c(SO32-)=$\frac{1}{2}$×2×10-3mol/L=1×10-3mol/L,根據Ksp=c(SO32-)•c(Ca2+)=3.1×10-7可知,c(Ca2+)=$\frac{3.1×1{0}^{-7}}{1×1{0}^{-3}}$mol/L=3.1×10-4mol/L,原溶液CaCl2溶液的最小濃度為混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小濃度為6.2×10-4mol/L,陽極是亞硫酸氫根氧化成硫酸根,而陰極是水中的氫離子放電生成氫氣,所以總的電解反應方程式為:2NaHSO3+H2O$\frac{\underline{\;電解\;}}{\;}$Na2SO3+H2SO4+H2↑,
故答案為:6.2×10-4mol/L; 2NaHSO3+H2O$\frac{\underline{\;電解\;}}{\;}$Na2SO3+H2SO4+H2↑.
點評 本題考查影響平衡的因素、化學平衡常數、化學平衡圖象、反應熱的計算、電極反應式的書寫等,難度中等,從化合價角度判斷電極發生反應的物質時關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3溶液可除油污:CO32-+H2O?HCO3-+OH- | |
| B. | NaHCO3可作發酵粉:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O | |
| C. | Na2CO3可用NaOH溶液吸收CO2制備:2OH-+CO2═CO32-+H2O | |
| D. | NaHCO3與食醋混用,產生CO2氣體:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. .
. 的合成路線(無機原料任選).
的合成路線(無機原料任選).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 H2SO3; H2SO3
H2SO3; H2SO3  H++HSO3-;HSO3-
H++HSO3-;HSO3-  H++SO32-.
H++SO32-.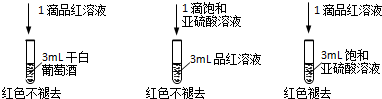
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 屠呦呦因對青蒿素的研究而獲得諾貝爾生理學或醫學獎,青蒿素可以青蒿酸(結構簡式如圖所示)為原料合成,下列關于青蒿酸的說法中正確的是( )
屠呦呦因對青蒿素的研究而獲得諾貝爾生理學或醫學獎,青蒿素可以青蒿酸(結構簡式如圖所示)為原料合成,下列關于青蒿酸的說法中正確的是( )| A. | 分子式為C15H24O2 | B. | 屬子芳香族化合物 | ||
| C. | 能發生取代反應和加成反應 | D. | 分子中所有原子可能共平面 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K=$\frac{[C]•[{H}_{2}O]}{[CO]•[{H}_{2}]}$ | B. | K=$\frac{[CO]•[{H}_{2}]}{[C]•[{H}_{2}O]}$ | C. | K=$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$ | D. | K=$\frac{[{H}_{2}O]}{[CO]•[{H}_{2}]}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com