

 .
. .
. 的合成路線(無機原料任選).
的合成路線(無機原料任選).分析 結合C的結構簡式可知C7H8為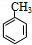 ,由轉化關系可知,甲苯與氯氣在光照條件下發生取代反應生成C7H7Cl為
,由轉化關系可知,甲苯與氯氣在光照條件下發生取代反應生成C7H7Cl為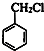 ,再發生水解反應得到A為
,再發生水解反應得到A為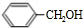 ,苯甲醇與乙二醇褪去1分子式水得到B為
,苯甲醇與乙二醇褪去1分子式水得到B為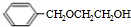 ,B發生消去反應生成C(
,B發生消去反應生成C(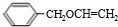 ).根據G的結構簡式與轉化關系可知,C4H6為CH2=CHCH=CH2,與溴發生1,4-加成生成D為BrCH2CH=CHCH2Br,D發生水解反應得到E為HOCH2CH=CHCH2OH,E發生與HCl發生加成反應得到F為HOCH2CH2CHClCH2OH,F發生氧化反應得到G,G發生消去反應、酸化得到I為HOOCCH=CHCOOH,則H為NaOOCCH=CHCOONa,H和C發生加聚反應生成P,則P的結構簡式為:
).根據G的結構簡式與轉化關系可知,C4H6為CH2=CHCH=CH2,與溴發生1,4-加成生成D為BrCH2CH=CHCH2Br,D發生水解反應得到E為HOCH2CH=CHCH2OH,E發生與HCl發生加成反應得到F為HOCH2CH2CHClCH2OH,F發生氧化反應得到G,G發生消去反應、酸化得到I為HOOCCH=CHCOOH,則H為NaOOCCH=CHCOONa,H和C發生加聚反應生成P,則P的結構簡式為: .
.
解答 解:結合C的結構簡式可知C7H8為 ,由轉化關系可知,甲苯與氯氣在光照條件下發生取代反應生成C7H7Cl為
,由轉化關系可知,甲苯與氯氣在光照條件下發生取代反應生成C7H7Cl為 ,再發生水解反應得到A為
,再發生水解反應得到A為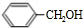 ,苯甲醇與乙二醇褪去1分子式水得到B為
,苯甲醇與乙二醇褪去1分子式水得到B為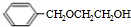 ,B發生消去反應生成C(
,B發生消去反應生成C(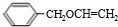 ).根據G的結構簡式與轉化關系可知,C4H6為CH2=CHCH=CH2,與溴發生1,4-加成生成D為BrCH2CH=CHCH2Br,D發生水解反應得到E為HOCH2CH=CHCH2OH,E發生與HCl發生加成反應得到F為HOCH2CH2CHClCH2OH,F發生氧化反應得到G,G發生消去反應、酸化得到I為HOOCCH=CHCOOH,則H為NaOOCCH=CHCOONa,H和C發生加聚反應生成P,則P的結構簡式為:
).根據G的結構簡式與轉化關系可知,C4H6為CH2=CHCH=CH2,與溴發生1,4-加成生成D為BrCH2CH=CHCH2Br,D發生水解反應得到E為HOCH2CH=CHCH2OH,E發生與HCl發生加成反應得到F為HOCH2CH2CHClCH2OH,F發生氧化反應得到G,G發生消去反應、酸化得到I為HOOCCH=CHCOOH,則H為NaOOCCH=CHCOONa,H和C發生加聚反應生成P,則P的結構簡式為: .
.
(1)反應①是甲苯與氯氣在光照條件下生成 ,反應⑦是HOOCCH2CHClCOOH在氫氧化鈉醇溶液、加熱條件下發生的消去反應,
,反應⑦是HOOCCH2CHClCOOH在氫氧化鈉醇溶液、加熱條件下發生的消去反應,
故答案為:氯氣、光照;氫氧化鈉醇溶液、加熱;
(2)反應③屬于消去反應,反應⑥屬于加成反應,
故答案為:消去反應;加成反應;
(3)E的結構簡式為HOCH2CH=CHCH2OH,P的結構簡式為: ,
,
故答案為:HOCH2CH=CHCH2OH; ;
;
(4)反應中⑦中將羥基氧化為羧基,也可以氧化碳碳雙鍵,設計反應⑥⑦的目的是:保護碳碳雙鍵,防止被氧化,
故答案為:保護碳碳雙鍵,防止被氧化;
(5)符合下列要求的G的同分異構體:Ⅰ.能發生銀鏡反應,說明含有醛基,Ⅱ.只含兩種化學環境不同的氫原子,Ⅲ.不含-O-O-結構,符合條件的同分異構體為: ,
,
故答案為: ;
;
(6)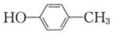 與溴發生取代反應生成
與溴發生取代反應生成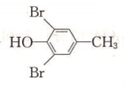 ,再與氫氣發生加成反應得到
,再與氫氣發生加成反應得到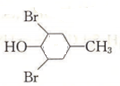 ,最后發生消去反應得到
,最后發生消去反應得到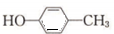 ,合成路線流程圖為:
,合成路線流程圖為: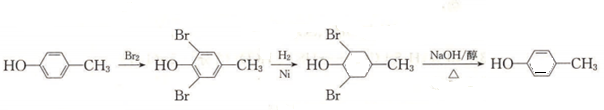 ,
,
故答案為: .
.
點評 本題考查了有機物推斷與合成,充分利用轉化關系中物質的結構、反應條件進行推斷,需要學生熟練掌握官能團的性質與轉化,較好的考查學生分析推理能力,題目難度中等.


科目:高中化學 來源: 題型:解答題
| 操作 | 步驟及現象 |
 | i:往溶液中緩慢通入SO2,液面上方有紅棕色氣體,溶液黃色無明顯變化 ii:繼續通入足量的SO2,溶液變為深棕色,一段時間后,溶液變為淺綠色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 發生化學反應時失去電子越多的金屬原子,還原能力越強 | |
| B. | 活潑非金屬單質在氧化還原反應中只作氧化劑 | |
| C. | 陽離子只有氧化性,陰離子只有還原性 | |
| D. | 含有某元素最高價態的化合物不一定具有強氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 通入少量SO2,溶液漂白性增強 | |
| B. | 加入少量NaHCO3固體,c(ClO)減小 | |
| C. | 加入少量水,水的電離平衡向正方向移動 | |
| D. | 加入NaOH固體至恰好完全反應,一定有c(Na+)=c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| B. | 0.1 mol/L的AlCl3溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 25℃時,水電離出的c(H+)=1×l0-l3 mol/L的溶液中:K+、Ba2+、NO3-、S2- | |
| D. | 能使酚酞變紅的溶液:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
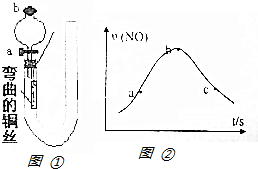 如圖①是某化學興趣小組同學設計的研究銅和稀硝酸反應速率[v(NO)]的實驗裝置圖.試回答下列問題:
如圖①是某化學興趣小組同學設計的研究銅和稀硝酸反應速率[v(NO)]的實驗裝置圖.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2:3 | B. | 3:4:3 | C. | 6:3:2 | D. | 4:3:4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com