
分析 (1)根據反應物、生成物書寫方程式,該反應中N元素化合價由+3價變為+2價、+5價,根據硝酸和轉移電子之間的關系式計算;
(2)根據氧化劑氧化性強于氧化產物氧化性分析;
(3)反應中生成NO,NO易與空氣中氧氣反應生成紅棕色的NO2氣體,同時形成酸霧;
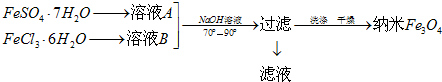
(4)硫酸亞鐵易被氧化為硫酸鐵,硫酸亞鐵為強酸弱堿鹽,易發生水解,FeSO4•7H2O和FeCl3•6H2O在氫氧化鈉溶液中生成四氧化三鐵、水、氯化鈉;根據電荷守恒可寫出該方程式,根據方程式求解理論上FeSO4•7H2O和FeCl3•6H2O的物質的量之比;
(5)共沉淀法制備納米級Fe3O4的關鍵為FeSO4•7H2O和FeCl3•6H2O的物質的量之比為1:2,Fe2+易被氧化為Fe3+,產品有雜質;
(6)根據題意磁流體分散系分散質粒子直徑在10納米以下,屬于膠體的范疇,所以應具備膠體的性質,根據膠體的性質分析.
解答 解:(1)由反應物和生成物可寫出反應的化學方程式為3NF3+5H2O=2NO+HNO3+9HF,NF3→NO,化合價降低1價,被還原,NF3→HNO3,化合價升高2價,被氧化,由方程式可知若反應中生成0.2mol HNO3,轉移的電子的物質的量為0.2mol×(5-3)=0.4mol,轉移的電子數目為0.4NA個,
故答案為:3NF3+5H2O=2NO+HNO3+9HF;0.4NA;
(2)由4NH3+3F2=NF3+3NH4F可知氧化劑:F2、氧化產物:NF3,所以氧化性F2>NF3,由3NF3+5H2O=2NO+HNO3+9HF可知氧化劑:NF3、氧化產物:HNO3,硝酸氧化性強于NO,所以氧化性NF3>NO,則氧化性F2>NF3>NO,
故答案為:F2>NF3>NO;
(3)NO易與空氣中氧氣反應生成紅棕色的NO2氣體,同時生成的HF和HNO3易結合空氣中的水蒸氣形成酸霧,有刺激性氣味,
故答案為:產生紅棕色氣體,產生刺激性氣味氣體,產生白霧;
(4)硫酸亞鐵易被氧化為硫酸鐵,常加入少量鐵粉防止亞鐵離子被氧化,加入硫酸防止其水解,生成Fe3O4的反應物為Fe2+、Fe3+和OH-,根據電荷守恒可寫出該離子方程式為Fe2++2Fe3++8OH-=Fe3O4+4H2O,化學方程式為FeSO4•7H2O+2FeCl3•6H2O+8NaOH=Fe3O4↓+17H2O+Na2SO4+6NaCl,FeSO4•7H2O和FeCl3•6H2O的物質的量之比為1:2,
故答案為:鐵粉、硫酸;1:2;
(5)共沉淀法制備納米級Fe3O4的反應為FeSO4•7H2O+2FeCl3•6H2O+8NaOH=Fe3O4↓+17H2O+Na2SO4+6NaCl,Fe2+易被氧化為Fe3+,無法控制FeSO4•7H2O和FeCl3•6H2O的物質的量之比為1:2,產品有雜質,
故答案為:Fe2+易被氧化為Fe3+,很難控制FeSO4•7H2O和FeCl3•6H2O的物質的量之比為1:2,產品含有雜質;
(6)根據題意磁流體分散系分散質粒子直徑在10納米以下,屬于膠體的范疇,具備膠體的性質.
A.分散質粒子直徑在10納米以下,所得分散系為膠體,所以不是溶液,故A錯誤;
B.該分散性屬于膠體,膠體可以通過滲析法得到提純,故B正確;
C.該分散性屬于膠體,膠體有丁達爾效應,所以當一束強光通過此磁流體時會出現光亮的通路,故C正確;
D.所得分散系為膠體,較穩定,屬于介穩體系,故D正確;
故答案為:A.
點評 本題考查含氮、鐵化合物的性質以及氧化還原反應,題目難度中等,注意從化合價變化的角度分析氧化還原反應的有關概念和計算,注意把握題給信息,為解答該題的關鍵.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:解答題
 按要求完成下列填空:
按要求完成下列填空:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:
溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸點/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 ;繼續滴加至液溴滴完.儀器a的名稱是三頸燒瓶;裝置d中的作用是吸收HBr氣體.儀器c為冷凝管,其進水口為下(填“上”或“下”)口.
;繼續滴加至液溴滴完.儀器a的名稱是三頸燒瓶;裝置d中的作用是吸收HBr氣體.儀器c為冷凝管,其進水口為下(填“上”或“下”)口.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | OH-+H+═H2O | B. | OH-+CO32-+2H+═HCO3-+H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 陰離子 | OH-、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| 物質鑒定試驗 | 推導結論 |
| ①用pH試紙測出A、B溶液呈堿性,C、D、E溶液呈酸性 | A、B中含有的陰離子為CO32-、OH-,C、D、E中含有的陽離子為H+、Al3+、Ag+ |
| ②A溶液與E溶液反應,既有氣體產生又有沉淀產生,A與C反應只有氣體產生 | A為Na2CO3,C含H+ |
| ③D溶液與另外四種溶液反應都能產生沉淀;C只能與D反應產生沉淀 | D為AgNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4g 氦氣中含有的分子數為NA | |
| B. | 常溫常壓下,22.4LCl2中含有的分子數為NA | |
| C. | 1L1mol/LK2SO4溶液中含有的鉀離子數為NA | |
| D. | 1mol鈉原子中含有的電子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3+HCl═NH4Cl | B. | 2H2O═2H2+O2 | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | C+H2O(g)═CO+H2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com