
| 陽離子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 陰離子 | OH-、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| 物質鑒定試驗 | 推導結論 |
| ①用pH試紙測出A、B溶液呈堿性,C、D、E溶液呈酸性 | A、B中含有的陰離子為CO32-、OH-,C、D、E中含有的陽離子為H+、Al3+、Ag+ |
| ②A溶液與E溶液反應,既有氣體產生又有沉淀產生,A與C反應只有氣體產生 | A為Na2CO3,C含H+ |
| ③D溶液與另外四種溶液反應都能產生沉淀;C只能與D反應產生沉淀 | D為AgNO3 |
分析 (1)根據題目給定的陽離子和陰離子組合出物質,碳酸根水解顯堿性,鋁離子和銀離子水解顯酸性,結合物質間反應的現象確定物質的名稱;
(2)硫酸鋁和過量的氫氧化鋇反應,硫酸鋁全部反應,鋁離子和硫酸根之間按照物質的量之比是2:3進行反應;
(3)硫酸鋁和氫氧化鈉反應生成氫氧化鋁的量和氫氧化鈉的量的多少有關.
解答 解:(1)①A、B溶液呈堿性,在所給的各種離子中,碳酸根水解顯堿性,氫氧根有堿性,所以A、B中含有的陰離子為碳酸根和氫氧根,又因為鋁離子和銀離子水解顯酸性,氫離子顯酸性,所以C、D、E溶液含有的陽離子為H+、Al3+、Ag+,故答案為:CO32-、OH-;H+、Al3+、Ag+;
②Na2CO3和可溶性的鋁鹽反應的實質是:鋁離子和碳酸根離子之間雙水解反應,產物既有沉淀又有氣體,所以A是碳酸鈉,B是氫氧化鋇,碳酸鈉和酸反應會產生二氧化碳氣體,故C中含有氫離子,故答案為:Na2CO3;H+;
③在所有的陽離子和陰離子組成的物質中,硝酸銀能和鹽酸、氯化鈉、硫酸鋁、氫氧化鋇反應生成沉淀,所以D是硝酸銀,C是鹽酸,故答案為:AgNO3;
(2)硫酸鋁和過量的氫氧化鋇反應,鋁離子和硫酸根之間按照物質的量之比是2:3,即2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓,
故答案為:2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓;
(3)硫酸鋁和氫氧化鈉的反應實質為:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=[Al(OH)4]-,100mL 0.1mol/L的硫酸鋁溶液中,含有鋁離子的物質的量為0.02mol,35mL 2mol/L NaOH溶液中含有氫氧化鈉物質的量為0.07mol,0.02mol鋁離子消耗0.06mol的氫氧化鈉生成0.02mol的氫氧化鋁,然后0.01mol的氫氧化鈉又將0.01mol的氫氧化鋁溶解,所以剩余氫氧化鋁的物質的量是0.01mol,反應的離子方程式為:2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O,
故答案為:2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O.
點評 本題考查無機物的推斷,離子性質和反應現象的理解應用,主要是鋁離子及其化合物性質的分析,題目較為綜合,難度較大,正確推斷各種物質為解答本題的關鍵.


科目:高中化學 來源: 題型:選擇題
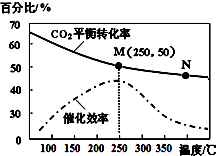 一定條件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化劑}{?}$CH2=CH2(g)+4H2O(g);已知溫度對CO2的平衡轉化率和催化劑催化效率的影響如圖,下列說法不正確的是( )
一定條件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化劑}{?}$CH2=CH2(g)+4H2O(g);已知溫度對CO2的平衡轉化率和催化劑催化效率的影響如圖,下列說法不正確的是( )| A. | 該反應的逆反應為吸熱反應 | |
| B. | 平衡常數:KM>KN | |
| C. | 生成乙烯的速率:v(N)一定大于v(M) | |
| D. | 當溫度高于250℃,升高溫度,催化劑的催化效率降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明礬是常用的凈水劑、具有殺菌、消毒的作用 | |
| B. | BaSO4在醫學上用作鋇餐,Ba2+對人體無毒 | |
| C. | 考古時,利用14C測定一些文物的年代 | |
| D. | 煤的干餾和石油的分餾都是化學變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 直接用酒精燈的外焰加熱蒸發皿 | |
| B. | 加熱過程中不斷用玻璃棒攪拌 | |
| C. | 加熱到液體全部消失 | |
| D. | 蒸發皿中出現多量晶體、少量液體時,停止加熱,利用蒸發皿的余熱烘干 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 反應時間/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com