
| A. | 0.1mol•L-1Na2CO3溶液中,c(OH)-=c(H+)+c(HCO3-)+c(H2CO3) | |
| B. | 相同物質的量濃度的NaCN和NaClO相比,NaCN溶液的pH較大,則對于同溫、同體積、同pH的HCN和HClO分別與Na0H恰好完全反應時,消耗NaOH的物質的量:HClO<HCN | |
| C. | 向醋酸鈉溶液中加入適量醋酸,得到酸性的混合溶液:c(Na+)>c(CH3COO-)>C(H+)>c(OH-) | |
| D. | 向硝酸鈉溶液中滴加稀鹽酸得到pH=5的混合溶液:c(Na+)=c(NO3-)+c(Cl-) |
分析 A.0.1mol•L-1Na2CO3溶液中存在質子守恒,水電離出的氫離子濃度和氫氧根離子濃度相同,但碳酸根離子結合水電離出的氫離子形成弱電解質,溶液中氫氧根離子濃度等于溶液中所有氫離子的存在形式總和;
B.相同物質的量濃度的NaCN和NaClO相比,NaCN溶液的pH較大,說明CN-水解程度大于ClO-,證明HCN酸性小于HClO,同溫、同體積、同pH的HCN和HClO溶液,HCN溶液濃度大于HClO的濃度;
C.依據溶液中電荷守恒分析判斷離子濃度大小;
D.pH=5的混合溶液,鈉離子、硝酸根離子不電離、不水解.
解答 解:A.根據質子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故A錯誤;
B.相同物質的量濃度的NaCN和NaClO相比,NaCN溶液的pH較大,說明CN-水解程度大于ClO-,證明HCN酸性小于HClO,同溫、同體積、同pH的HCN和HClO溶液,HCN溶液濃度大于HClO的濃度,消耗NaOH的物質的量HCN溶液消耗的多,故B正確;
C.向醋酸鈉溶液中加入適量醋酸,得到酸性的混合溶液,溶液中c(H+)>c(OH-),溶液中存在電荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),則c(Na+)<c(CH3COO-),故C錯誤;
D.向硝酸鈉溶液中滴加稀鹽酸得到的pH=5的混合溶液中,離子不發生水解,c(Na+)=c(NO3-),故D錯誤;
故選B.
點評 本題考查了離子濃度大小的比較,明確鹽類水解的應用及質子守恒、電荷守恒即可解答,注意選項D為易錯點,題目難度中等.


 53天天練系列答案
53天天練系列答案科目:高中化學 來源: 題型:解答題
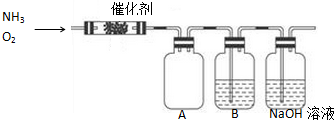
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
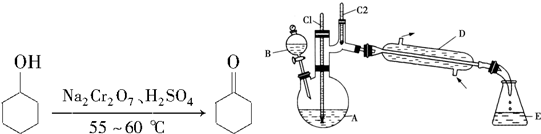
| 物質 | 沸點(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 環己醇 | 161.1(97.8) | 0.962 4 | 能溶于水 |
| 環己酮 | 155.6(95) | 0.947 8 | 微溶于水 |
| 飽和食鹽水 | 108.0 | 1.330 1 | |
| 水 | 100.0 | 0.998 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L0.2mol/L CaCl2溶液中含Cl-數為0.2×6.02×1023 | |
| B. | 22gCO2含有0.5mol CO2分子,體積為11.2L | |
| C. | 3.01×1023個水分子的摩爾質量為9g/mol | |
| D. | 3.2g O2和3.2g O3含氧原子的數目相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向NaClO溶液通入少量SO2氣體:3ClO-+SO2+H2O=SO${\;}_{4}^{2-}$+Cl-+2HCl | |
| B. | 將過量的Cl2通入FeBr2中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 向碳酸氫鈣溶液滴加氫氧化鈉溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至沉淀量最大:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知制備甲醇的有關化學反應及平衡常數如表所示:
已知制備甲醇的有關化學反應及平衡常數如表所示:| 化學反應 | 反應熱 | 平衡常數(850℃) |
| ①CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g) | △H1=-48.8 kJ•molˉ1 | K1=320 |
| ②CO(g)+H2O(g)═H2(g)+CO2(g) | △H2=-41.2 kJ•molˉ1 | K2 |
| ③CO(g)+2H2(g)═CH3OH(g) | △H3 | K3=160 |
| 物質 | H2 | CO2 | CH3OH | H2O |
| 濃度(mol•Lˉ1) | 0.2 | 0.2 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應速率:乙>甲 | |
| B. | 平衡混合物中SO2的體積分數:乙>甲 | |
| C. | SO2的轉化率:乙>甲 | |
| D. | 平衡時O2的體積分數:甲>乙 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com