
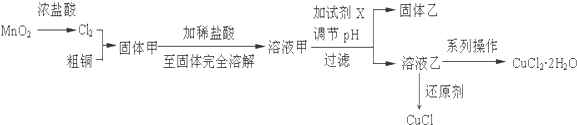

分析 粗銅中雜質只有Fe,與氯氣反應得到固體甲中有氯化銅、氯化鐵,用鹽酸溶解,抑制氯化銅、氯化鐵水解,溶液甲中加入X調節溶液pH,得到溶液乙,經過系列操作得到CuCl2•2H2O,故溶液乙為CuCl2溶液,則調節pH目的是使溶液中鐵離子轉化為Fe(OH)3沉淀,過濾除去,試劑X可以為CuO、氫氧化銅等,結合題目信息可知,氯化銅溶液,加少量鹽酸,抑制氯化銅水解,再蒸發濃縮、冷卻到26~42℃結晶得到CuCl2•2H2O,再經過過濾、洗滌、干燥得到純凈的晶體.
(1)①制取純凈、干燥的氯氣并與Cu反應,因為濃鹽酸制取的氯氣中含有HCl,先用飽和食鹽水除去,再用濃硫酸干燥,干燥后的氯氣與Cu反應,剩余的氯氣用氫氧化鈉溶液吸收,防止污染空氣;
②應先制備氯氣,排出裝置中空氣,防止銅被氧氣氧化;
(2)①氯化銅、氯化鐵在溶液中會發生水解;
②調節pH目的是使溶液中鐵離子轉化為Fe(OH)3沉淀,過濾除去,且不能引入新雜質;
③結合題目信息可知,氯化銅溶液,加少量鹽酸,抑制氯化銅水解,再蒸發濃縮、冷卻到26~42℃得到CuCl2•2H2O,再經過過濾、洗滌、干燥得到純凈的晶體;
(3)氯化銅與N2H4反應得到CuCl,氧化產物為無毒氣體,即為氮氣,由元素守恒可知,反應還生成HCl;
由于CuCl在熱水中迅速水解生成氧化銅水合物,應微熱維持反應發生,防止CuCl水解生成氧化銅水合物;
(4)根據Cu元素守恒計算CuCl2•2H2O理論質量,進而計算其產率;在調節溶液pH時,加入CuO或氫氧化銅,會導致CuCl2•2H2O質量增大.
解答 解:粗銅中雜質只有Fe,與氯氣反應得到固體甲中有氯化銅、氯化鐵,用鹽酸溶解,抑制氯化銅、氯化鐵水解,溶液甲中加入X調節溶液pH,得到溶液乙,經過系列操作得到CuCl2•2H2O,故溶液乙為CuCl2溶液,則調節pH目的是使溶液中鐵離子轉化為Fe(OH)3沉淀,過濾除去,試劑X可以為CuO、氫氧化銅等,結合題目信息可知,氯化銅溶液,加少量鹽酸,抑制氯化銅水解,再蒸發濃縮、冷卻到26~42℃得到CuCl2•2H2O,再經過過濾、洗滌、干燥得到純凈的晶體.
(1)①制取純凈、干燥的氯氣并與Cu反應,因為濃鹽酸制取的氯氣中含有HCl,先用飽和食鹽水除去,再用濃硫酸干燥,干燥后的氯氣與Cu反應,剩余的氯氣用氫氧化鈉溶液吸收,按氣流方向連接各儀器接口順序是:a→d、e→h、i→f、g→b,
故答案為:d、e、f、g、b;
②制取氯氣需要加熱,制取氯化銅需要加熱,先加熱A,再加熱D,目的是使產生的氯氣排除裝置內的空氣,防止Cu與氧氣反應,
故答案為:A;D;排出空氣,防止銅被氧氣氧化;
(2)①固體甲為氯化銅和氯化鐵的混合物,溶解時因為銅離子、鐵離子水解,所以應向溶液中加入少量的稀鹽酸,抑制氯化銅、氯化鐵的水解;
故答案為:抑制氯化銅、氯化鐵水解;
②調節pH目的是使溶液中鐵離子轉化為Fe(OH)3沉淀,過濾除去,且不能引入新雜質,而氫氧化鈉、氨水、硫酸銅均引入雜質,且加入硫酸銅,不能使鐵離子沉淀除去,故選:c;
③結合題目信息可知,氯化銅溶液,加少量鹽酸,抑制氯化銅水解,再蒸發濃縮、冷卻到26~42℃結晶得到CuCl2•2H2O,再經過過濾、洗滌、干燥得到純凈的晶體,
故答案為:冷卻到26~42℃結晶;過濾;
(3)氯化銅與N2H4反應得到CuCl,氧化產物為無毒氣體,即為氮氣,由元素守恒可知,反應還生成HCl,反應離子方程式為:4Cu2++4Cl-+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$4CuCl↓+N2↑+4H+;
由于CuCl在熱水中迅速水解生成氧化銅水合物,應微熱維持反應發生,防止CuCl水解生成氧化銅水合物;
故答案為:4Cu2++4Cl-+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$4CuCl↓+N2↑+4H+;微熱維持反應發生,溫度過高生成氧化銅水合物;
(4)根據Cu元素守恒,CuCl2•2H2O理論質量為$\frac{100g×96%}{64g/mol}$×171g/mol=256.5g,故其產率為$\frac{277g}{256.5g}$×100%=108%;在調節溶液pH時,加入CuO反應生成了CuCl2,使產品質量增加,
故答案為:108%;在調節溶液pH時,加入CuO反應生成了CuCl2,使產品質量增加.
點評 本題考查實驗制備方案,涉及對裝置的分析評價、物質的分離提純、對操作的分析評價、含量測定等,注意對題目信息的提取應用,側重考查學生分析解決問題的能力、知識遷移運用能力,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 中和10mL0.1mol•L-1HAc與中和100mL0.01mol•L-1HAc所需NaOH的物質的量不同 | |
| B. | 10mL0.1mol•L-1氨水與100mL0.01mol•L-1氨水,其OH-物質的量相同 | |
| C. | 相同條件下,將pH值相同的鹽酸和醋酸稀釋相同的倍數,鹽酸pH值變化較大 | |
| D. | 鋅分別與pH=3的鹽酸和pH=3的醋酸溶液反應,起始反應速率鹽酸較快 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
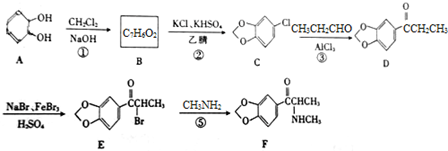
 ;
; (填結構簡式);
(填結構簡式); )的合成路線.
)的合成路線.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
; ;C的化學名稱為2,3-二甲基-1,3-丁二烯.
;C的化學名稱為2,3-二甲基-1,3-丁二烯.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
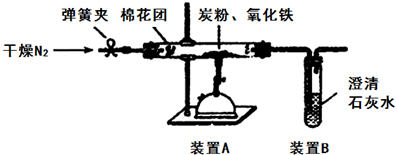
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,則氫氣的燃燒熱為241.8 kJ | |
| B. | 由C(石墨,s)═C(金剛石,s)△H=+11.9 kJ•mol-1可知,金剛石比石墨穩定 | |
| C. | 同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件的△H不同 | |
| D. | 任何一個化學變化都伴隨著能量的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
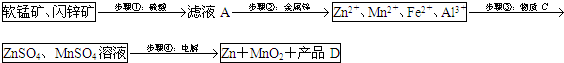
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com