
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/mol•L-1 | 4×10-6 | 6×10-4 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)依據電荷守恒,求出氫離子的濃度,帶入pH計算公式;
(2)①利用蓋斯定律,通過已知熱化學方程式運算得目標熱化學方程式;
②依據二氧化硫的性質:是一種酸性氧化物可以和堿反應,二氧化硫溶于水得亞硫酸,酸性強于碳酸,所以可以和碳酸鈉溶液反應;
(3)①列三段表示出各種物質平衡時的濃度,帶入平衡常數表達式;N2(g)+O2(g)?2NO(g)△H>0,該反應是吸熱反應,溫度升高,反應速率加快,平衡向正方向移動,單位時間內產生的NO多;
②利用反應能否自發進行的判據△H-T△S;
③CO和NOx在催化劑的作用下發生氧化還原反應生成無毒的二氧化碳和氮氣.
解答 解:(1)根據電荷守恒得:[H+]+[K+]+[Na+]+[NH4+]=2[SO42-]+[NO3-]+[Cl-],將表中數據帶入得:[H+]=10-4,pH=-lg[H+]=4,溶液呈酸性,
故答案為:酸性;4;
(2)①H2(g)+$\frac{1}{2}$O2(g)=H20 (g)△H=-241.8kJ•mol-1 ①
C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5kJ•mol-1②
利用蓋斯定律將方程式變形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案為:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
②二氧化硫是酸性氧化物所以具有酸性氧化物的通性能夠與堿反應:SO2+Ca(OH)2=CaSO3↓+H2O;
二氧化硫水溶液是亞硫酸所以也能夠與碳酸鈉反應:SO2+Na2CO3=Na2SO3+CO2↑所以可以用氫氧化鈣溶液和碳酸鈉溶液做洗滌劑; 二氧化硫與氯化鈣溶液不反應,且在亞硫酸氫鈉溶液中的溶解度很小,所以不能用氯化鈣和亞硫酸氫鈉溶液做洗滌液,
故答案為:ab;
(3)①設反應容器的體積是aL
根據題意得:
N2(g)+O2(g)?2NO(g)
初始濃度 $\frac{0.8}{a}$ $\frac{0.2}{a}$ 0
轉化濃度 $\frac{4×1{0}^{-4}}{a}$ $\frac{4×1{0}^{-4}}{a}$ $\frac{8×1{0}^{-4}}{a}$,
平衡濃度 $\frac{0.8}{a}$-$\frac{4×1{0}^{-4}}{a}$ $\frac{0.2}{a}$-$\frac{4×1{0}^{-4}}{a}$ $\frac{8×1{0}^{-4}}{a}$ 將各種物質的濃度帶入表達式 得K=$\frac{[NO]^{2}}{[{N}_{2}][{O}_{2}]}$≈4×10-6,
氣缸溫度越高,單位時間內NO排放量越大,原因是溫度升高,反應速率加快,平衡右移;
故答案為:4×10-6;溫度升高,反應速率加快,平衡右移;
②2CO(g)=2C(s)+O2(g)是一個熵值減小的反應即:△S<0,同時又是一個△H>O,所以△H-T△S一定大于0,所以任何條件下不能自發進行,
故答案為:因為該反應的△H>0,△S<0,所以任何溫度下均不自發進行;
③CO和NOx在催化劑發生反應:2CO+2N0$\frac{\underline{\;催化劑\;}}{\;}$2CO2+N2,故答案為:2CO+2N0$\frac{\underline{\;催化劑\;}}{\;}$2CO2+N2.
點評 本題考查了pH值的計算、蓋斯定律求反應熱、化學平衡常數的計算、反應進行方向的判斷,題目綜合性非常強,涉及知識點多,難度中等,同時又結合了環境的污染和治理,題目又比較新穎,是高考的熱門話題,解題時應該結合相應的知識,認真解答.


科目:高中化學 來源: 題型:選擇題
| A. | 現代化學元素分析測試中,可用元素分析儀確定物質中是否含有C、H、O、N、S、Cl、Br等元素,用紅外光譜儀確定物質中是否存在某些有機原子團,用原子吸收光譜確定物質中含有哪些金屬元素等 | |
| B. | 鈉鉀合金在常溫下是液體,可用于快中子反應堆作劑;鎂合金大量用于制造火箭、導彈和飛機的部件等 | |
| C. | 2015年浙江省多地遭遇霧霾天氣,有報道稱霧霾顆粒中汽車尾氣占20%以上,一致汽車尾氣中的主要污染物為NOx、CO、燃燒源超細顆粒(PM2.5)等有害物質,其中PM2.5(OM單位為百萬分之一米)顆粒大小約等于膠體粒子 | |
| D. | 如圖所示為四大基本反應及其關系,則反應4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O屬于區域3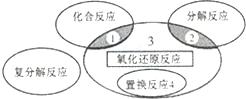 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 粒子半徑:F-<Mg2+<Al3+ | B. | 熱穩定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 堿性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氫氣是一種清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點.
氫氣是一種清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某無色稀溶液X中,可能含有下表所列離子中的某幾種.
某無色稀溶液X中,可能含有下表所列離子中的某幾種.| 陰離子 | CO32-、SiO32-、AlO2-、Cl- |
| 陽離子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向硫酸鋁溶液中加入過量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好為中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | FeSO4溶液與稀硫酸、雙氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaHCO3溶液中加入足量Ba(OH)2的溶液:Ba2++2HCO3-+2OH-=2H2O+BaCO3↓+CO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com