
 某無色稀溶液X中,可能含有下表所列離子中的某幾種.
某無色稀溶液X中,可能含有下表所列離子中的某幾種.| 陰離子 | CO32-、SiO32-、AlO2-、Cl- |
| 陽離子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
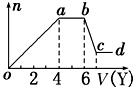
分析 (1)無色溶液中不會含有Fe3+,加入鹽酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于過量鹽酸中而后者不能,由圖象知溶液中肯定含有AlO2-、SiO32-.
oa段發生反應的離子為AlO2-、SiO32-,ab段為CO32-,bc段則是Al(OH)3溶解;
(2)當向溶液中加入NaOH時,生成的沉淀為Mg(OH)2、Al(OH)3,ab段是NH4+與OH-之間發生反應,因Mg2+、Al3+不能與CO32-、SiO32-、AlO2-共存,故此時溶液中陰離子只有Cl-.結合圖象,溶解Al(OH)3、與NH4+作用、生成Al(OH)3消耗的NaOH體積比為1:2:3;由此可求出與Mg2+反應時消耗的NaOH體積與溶解Al(OH)3消耗NaOH 溶液一樣多,故溶液中n(Al3+):n(Mg2+):n(NH4+)=2:1:4,最后就得到各種離子物質的量比.
解答 解:(1)某無色稀溶液X中,無色溶液中不會含有Fe3+,加入鹽酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于過量鹽酸中而后者不能,所以由圖象知溶液中含有SiO32-、AlO2-;則oa段發生反應的離子為AlO2-、SiO32-;ab段發生的反應沉淀的量不變,所以ab段為鹽酸與CO32-反應,bc段沉淀減少,則是Al(OH)3溶解于鹽酸,其反應的離子方程式為:Al(OH)3+3H+=Al3++3H2O.
故答案為:AlO2-、SiO32-;CO32-;Al(OH)3+3H+=Al3++3H2O;
(2)若Y是氫氧化鈉,向溶液中加氫氧化鈉溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或兩者中的一種,由于弱堿陽離子和弱酸根會雙水解而不能共存,即溶液中不含CO32-、SiO32-、AlO2-,由于溶液一定要保持電中性,故溶液中一定含Cl-;當a-b段時,沉淀的量不變化,是氫氧化鈉和銨根離子反應生成氣體:NH4++OH-═NH3•H2O,即溶液中含NH4+;當b-c段時沉淀的質量減少但沒有完全溶解,即部分沉淀和氫氧化鈉反應,部分沉淀不反應,說明溶液中有Al3+、Mg2+,即bc段的反應為:Al(OH)3+OH-═AlO2-+2H2O.
即則X中一定含有的離子是Al3+、Mg2+、NH4+、Cl-;由于溶液中有Al3+、Mg2+,故oa段轉化為沉淀的離子是Al3+、Mg2+,ab段是氫氧化鈉和銨根離子反應生成氣體,反應的離子方程式為NH4++OH-═NH3•H2O;溶液中有Al3+、Mg2+,即沉淀中含Al(OH)3和Mg(OH)2,故bc段的反應為:Al(OH)3+OH-═AlO2-+2H2O,
NH4+反應需要NaOH的體積是2V,由于Al(OH)3溶解時需要的NaOH的體積是V,則生成Al(OH)3需要的NaOH的體積是3V,而生成Mg(OH)2和Al(OH)3共消耗NaOH的體積為4V,則生成Mg(OH)2需要NaOH溶液的體積是V,則n(Al3+):n(Mg2+):n(NH4+)=2:1:4,
故答案為:Al3+、Mg2+、NH4+;2:1:4;NH4++OH-═NH3•H2O.
點評 本題考查離子檢驗及離子反應,根據溶液的顏色結合題給圖象確定溶液中存在的離子,再結合物質之間的反應來確定微粒的量,同時考查學生思維的縝密性、考慮問題的全面性,題目難度較大.


科目:高中化學 來源: 題型:選擇題
| A. | 鐵紅屬于鹽類 | B. | 明礬屬于堿類 | ||
| C. | SiO2屬于酸性氧化物 | D. | NaHCO3屬于酸類 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.4Q1+0.05Q2 | B. | 0.4Q1+0.05Q3 | C. | 0.4Q1+0.1Q3 | D. | 0.4Q1+0.2Q2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只能有一種分類標準 | B. | 分類標準不同,物質所屬類別不同 | ||
| C. | 可能有多種分類標準 | D. | 一種分類標準對應一種分類結果 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/mol•L-1 | 4×10-6 | 6×10-4 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2(HCl):用飽和NaHCO3溶液 | B. | CO2(SO2):用飽和KMnO4溶液 | ||
| C. | Cl2(HCl):用飽和NaCl溶液 | D. | SO2(HCl):用飽和NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
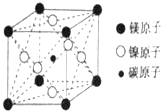 最近發現,只含鎂、鎳和碳三種元素的晶體竟然也具有超導性.因這三種元素都是常見元素,從而引起廣泛關注.該新型超導晶體的一個晶胞如圖所示,則該晶體的化學式為( )
最近發現,只含鎂、鎳和碳三種元素的晶體竟然也具有超導性.因這三種元素都是常見元素,從而引起廣泛關注.該新型超導晶體的一個晶胞如圖所示,則該晶體的化學式為( )| A. | MgCNi3 | B. | Mg2CNi3 | C. | MgCNi2 | D. | MgC2Ni |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com