

分析 稱取樣品W1g加入水溶解得到無色溶液,加入過量A溶液為BaCl2溶液,得到硫酸鋇沉淀、亞硫酸鋇沉淀,過濾洗滌得到濾液Ⅰ和白色沉淀Ⅱ,加入過量B溶液為是溶液使亞硫酸鈉溶解,過濾得到濾液Ⅱ和沉淀Ⅲ為硫酸鋇沉淀,用蒸餾水洗滌多次烘干得到純凈固體W2g,
(1)加入過量A溶液使為了沉淀完全硫酸根離子和亞硫酸根離子;檢驗A是否過量,可以取上層清液加入氯化鋇觀察是否有沉淀生成設計;
(2)分析可知B為鹽酸溶液,過量是為了全部溶解亞硫酸鋇沉淀;
(3)檢驗沉淀(Ⅲ)是否洗滌干凈應取最后一次洗滌液加入硝酸酸化的硝酸銀檢驗是否含氯離子或檢驗是否含硫酸根離子設計檢驗方法;
(4)W1為Na2SO3和Na2SO4質量,W2為BaSO4質量,計算硫酸鋇物質的量得到樣品中硫酸鈉物質的量,計算得到質量,用樣品質量減去硫酸鈉質量為亞硫酸鈉質量,得到亞硫酸鈉的質量分數;
解答 解:稱取樣品W1g加入水溶解得到無色溶液,加入過量A溶液為BaCl2溶液,得到硫酸鋇沉淀、亞硫酸鋇沉淀,過濾洗滌得到濾液Ⅰ和白色沉淀Ⅱ,加入過量B溶液為是溶液使亞硫酸鈉溶解,過濾得到濾液Ⅱ和沉淀Ⅲ為硫酸鋇沉淀,用蒸餾水洗滌多次烘干得到純凈固體W2g,
(1)加入過量A為BaCl2溶液使為了使 SO32-、SO42- 沉淀完全,檢驗BaCl2是否過量的方法是取上層清液少量,再加BaCl2溶液少量,若無沉淀生成,證明所加BaCl2溶液已過量或取上層清液少量,再加入Na2SO4溶液少量,若有沉淀生成,證明所加BaCl2溶液已過量,
故答案為:使 SO32-、SO42- 沉淀完全,取上層清液少量,再加BaCl2溶液少量,若無沉淀生成,證明所加BaCl2溶液已過量或取上層清液少量,再加入Na2SO4溶液少量,若有沉淀生成,證明所加BaCl2溶液已過量;
(2)加入B為鹽酸稍過量的理由是把亞硫酸鋇沉淀全部溶解,加入B發生反應的離子方程式是 BaSO3+2H+=Ba2++SO2↑+H2O,
故答案為:使BaSO3 全部溶解,BaSO3+2H+=Ba2++SO2↑+H2O;
(3)檢驗沉淀(Ⅲ)是否洗滌干凈應取最后一次洗滌液加入硝酸酸化的硝酸銀檢驗是否含氯離子或檢驗是否含硫酸根離子設計檢驗方法,步驟為:取最后一次洗滌液少量,加入用稀HNO3酸化的AgNO3溶液,若無沉淀產生,表示沉淀已經洗凈,
故答案為:取最后一次洗滌液少量,加入用稀HNO3酸化的AgNO3溶液,若無沉淀產生,表示沉淀已經洗凈;
(4)W1為Na2SO3和Na2SO4質量,W2為BaSO4質量,n(BaSO4)=n(Na2SO4)=$\frac{{W}_{2}}{233}$mol,用樣品質量減去硫酸鈉質量為亞硫酸鈉質量,得到亞硫酸鈉的質量分數=$\frac{{W}_{1}-\frac{{W}_{2}}{233}×142}{{W}_{1}}$×100%=(1-$\frac{{w}_{2}}{{w}_{1}}$×$\frac{142}{233}$)×100%,
故答案為:(1-$\frac{{w}_{2}}{{w}_{1}}$×$\frac{142}{233}$)×100%;
點評 本題看出來了物質組成和含量的測定實驗過程分析判斷,主要是物質性質,物質分離等知識點,主要是實驗過程的理解和計算應用,題目難度中等.


 導學教程高中新課標系列答案
導學教程高中新課標系列答案 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:解答題
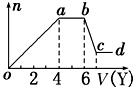 某無色稀溶液X中,可能含有下表所列離子中的某幾種.
某無色稀溶液X中,可能含有下表所列離子中的某幾種.| 陰離子 | CO32-、SiO32-、AlO2-、Cl- |
| 陽離子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鹽泥是氯堿工業中的廢渣,主要成分是鎂的硅酸鹽和碳酸鹽(含少量鐵、鋁、鈣的鹽).實驗室以鹽泥為原料制取MgSO4•7H2O的實驗過程如下:
鹽泥是氯堿工業中的廢渣,主要成分是鎂的硅酸鹽和碳酸鹽(含少量鐵、鋁、鈣的鹽).實驗室以鹽泥為原料制取MgSO4•7H2O的實驗過程如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.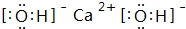 ,C的最高價氧化物的水化物化學式為:Al(OH)3.
,C的最高價氧化物的水化物化學式為:Al(OH)3.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向硫酸鋁溶液中加入過量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好為中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | FeSO4溶液與稀硫酸、雙氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaHCO3溶液中加入足量Ba(OH)2的溶液:Ba2++2HCO3-+2OH-=2H2O+BaCO3↓+CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋰是較輕的金屬 | B. | LiOH的堿性比NaOH弱 | ||
| C. | 鋰的化學性質比鈉活潑 | D. | 鋰在空氣中燃燒生成Li2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該元素基態原子核外共有7種運動狀態不同的電子 | |
| B. | 該元素位于周期表的S 區,屬于金屬元素 | |
| C. | 該元素在周期表中的位置第四周期第VA族 | |
| D. | 該元素M層含有11個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(N2)正=v(NH3)逆 | |
| B. | 單位時間內3molH-H鍵斷裂,同時6molN-H鍵斷裂 | |
| C. | n(N2):n(H2):(NH3)=1:3:2 | |
| D. | 混合氣體的密度不再改變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com