
| 實 驗 步 驟 | 解 釋 或 實 驗 結 論 |
| (1)稱取A 9.0g,升溫使其汽化,測其密度是相同條件下H2的45倍. | 試通過計算填空:(1)A的摩爾質量為:90. |
| (2)將此9.0g A在足量純O2充分燃燒,并使其產物依次緩緩通過濃硫酸、堿石灰,發現分別增重5.4g和13.2g. | (2)A的分子式為 :C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反應,生成2.24L CO2(標準狀況),若與足量金屬鈉反應則生成2.24L H2(標準狀況). | (3)A中含有官能團的名稱: 羧基、羥基. |
(4)A的核磁共振氫譜如圖: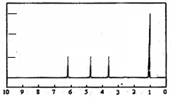 | (4)A中含有1個手性碳原子. |
(5)綜上所述,A的結構簡式為: . . | |
分析 (1)同溫同壓下,氣體的密度之比等于相對分子質量之比,據此計算;
(2)濃硫酸增重7.2g為水的質量,堿石灰增重17.6g為二氧化碳質量,計算有機物、水、二氧化碳物質的量,進而計算n(H)、n(C),根據質量守恒確定是否含有O元素,根據元素守恒來確定有機物的分子式;
(3)能與足量的NaHCO3粉末反應,說明含有-COOH,根據生成的二氧化碳的物質的量確定-COOH數目,能與鈉反應生成氫氣,結合生成氫氣的物質的量確定是否含有-OH及羥基數目;
(4)核磁共振氫譜圖中有幾個峰值則含有幾種類型的等效氫原子,峰面積之比等于氫原子的數目之比,確定結構簡式,可確定手性碳原子數目;
(5)由A的分子式、含有的官能團及核磁共振氫譜書寫其結構簡式.
解答 解:(1)由其密度是相同條件下H2的45倍,可知A的相對分子質量為45×2=90,
故答案為:90;
(2)由題意可推知:n(A)=$\frac{9.0g}{90g/mol}$=0.1 mol,n(C)=n(CO2)=$\frac{13.2g}{44g/mol}$=0.3 mol,n(H)=2n(H2O)=2×$\frac{5.4g}{18g/mol}$=0.6 mol,
n(O)=$\frac{9g-0.3×12g-0.6×1g}{16g/mol}$=0.3 mol,
所以A的分子式為:C3H6O3,
故答案為:C3H6O3;
(3)0.1 mol A與NaHCO3反應放出0.1 mol CO2,則說A中應含有一個羧基,而與足量金屬鈉反應則生成0.1 mol H2,說明A中還含有一個羥基,
故答案為:羧基、羥基;
(4)核磁共振氫譜中有4個吸收峰,面積之比為1:1:1:3,可知A中應含有4種不同環境的氫原子,共含有3個C原子,其中1個為甲基、一個為羧基,則只有一個手性碳原子,
故答案為:1;
(5)綜上所述,A的結構簡式為: ,
,
故答案為: .
.
點評 本題考查有機物的推斷,為高頻考點,側重于學生的分析、計算能力的考查,題目難度中等,注意掌握常見有機物結構與性質,根據A和碳酸氫鈉、鈉反應時生成氣體體積判斷含有的官能團類型為解答關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 同濃度、同體積的強酸與強堿溶液混合后,溶液的 pH=7 | |
| B. | 0.1 mol•L-1 NH4Cl 溶液與 0.1 mol•L-1氨水等體積混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol AgCl 和 0.1 mol AgI 混合后加入水中,所得溶液 c(Cl-)=c(I-) | |
| D. | 向 0.10 mol•L-1 Na2SO3溶液中通 SO2氣體至溶液 pH=7:c(Na+)<2[c(SO23-)+c(HSO3-)+c(H2SO3)] |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 結晶牛胰島素 | B. | 氰酸銨 | C. | 葡萄糖 | D. | 尿素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鈉溶液與稀硫酸的反應 | |
| B. | Ba(OH)2•8H2O晶體與NH4Cl晶體的反應 | |
| C. | 甲烷在空氣中燃燒的反應 | |
| D. | 灼熱的木炭與CO2的反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗內容 | 實驗現象 | 有關反應的方程式或結論 |
| ①取磨光后鎂條與鋁條,分別投入稀鹽酸中 | Mg+2HCl=MgCl2+H2↓ 2Al+6HCl=2AlCl3+3H2↓ 說明金屬性的強弱順序為:Mg>Al | |
| ②向MgCl2、AlCl3溶液中分別逐滴滴入NaOH溶液至過量 | 與MgCl2溶液反應產生白色沉淀,與AlCl3溶液反應先產生白色沉淀,而后沉淀完全溶解 | AlCl3溶液與NaOH溶液反應的化學方程式:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O |
| ③向新制的Na2S溶液中滴入新制的氯水 | 生成淡黃色的沉淀 | 反應的化學方程式為:Na2S+Cl2=S↓+2NaCl |
| ④向各為1mol/L的H2SO4、H3PO4溶液中投入鎂條 | 鎂與H2SO4反應更劇烈,迅速產生大量無色氣體 | 說明非金屬性的強弱順序為:S>P |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向水中加入KHSO4溶液,平衡逆向移動,Kw減小 | |
| B. | 將水加熱,Kw增大,pH減小,但還是中性 | |
| C. | 向水中加入少量CH3COONa固體,平衡逆向移動,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移動,KW增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
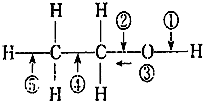
| A. | 和金屬鈉反應時斷裂① | |
| B. | 乙醇燃燒時斷裂②和⑤ | |
| C. | 在銀催化條件下,與O2反應時斷裂①和③ | |
| D. | 和濃H2SO4、乙酸共熱時斷裂①,其他鍵不變化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com