下列說(shuō)法正確的是( )
| A、濃硫酸是強(qiáng)電解質(zhì),醋酸是弱電解質(zhì) |
| B、電解質(zhì)都能導(dǎo)電,非電解質(zhì)都不能導(dǎo)電 |
| C、酸性氧化物都是非金屬氧化物,堿性氧化物都是金屬氧化物 |
| D、氫氧化鐵膠體電泳時(shí)陰極附近顏色加深 |
考點(diǎn):強(qiáng)電解質(zhì)和弱電解質(zhì)的概念,酸、堿、鹽、氧化物的概念及其相互聯(lián)系,膠體的重要性質(zhì)
專(zhuān)題:
分析:A.電解質(zhì)非電解質(zhì)都是化合物;
B.溶解度較小的電解質(zhì),在水溶液中不導(dǎo)電,如氯化銀、硫酸鋇等;
C.酸性氧化物是和堿反應(yīng)生成鹽和水的氧化物;堿性氧化物是和酸反應(yīng)生成鹽和水,堿性氧化物都是金屬氧化物;
D.Fe(OH)3 膠體粒子帶正電.
解答:
解:A.濃硫酸是混合物,既不是電解質(zhì)也不是非電解質(zhì),故A錯(cuò)誤;
B.有的電解質(zhì)溶解度很小,在水中幾乎不導(dǎo)電,如硫酸鋇為電解質(zhì),硫酸鋇在水中不導(dǎo)電,故B錯(cuò)誤;
C.酸性氧化物是和堿反應(yīng)生成鹽和水的氧化物,酸性氧化物都可以與強(qiáng)堿反應(yīng),可以是非金屬氧化物如CO2,也可以是金屬氧化物,如Mn2O7是酸性氧化物,堿性氧化物是和酸反應(yīng)生成鹽和水的氧化物,都是金屬氧化物,故C錯(cuò)誤;
D.Fe(OH)3 膠體粒子帶正電,在電場(chǎng)中向陰極方向移動(dòng),陰極附近顏色加深,故D正確;
故選D.
點(diǎn)評(píng):本題考查了強(qiáng)電解質(zhì)和弱電解質(zhì)的概念、氧化物的概念、膠體的性質(zhì),難度較小.注意酸性氧化物可以是金屬氧化物.
練習(xí)冊(cè)系列答案
相關(guān)習(xí)題
科目:高中化學(xué)
來(lái)源:
題型:
A、B、C、D、E代表5種元素.請(qǐng)?zhí)羁眨?br />(1)A元素基態(tài)原子的最外層有3個(gè)未成對(duì)電子,次外層有2個(gè)電子,其元素符號(hào)為
,其氣態(tài)氫化物化學(xué)式為
.
(2)B元素的負(fù)一價(jià)離子和C元素的正一價(jià)離子的電子層結(jié)構(gòu)都與氬相同,B的元素符號(hào)為
,其最高價(jià)氧化物的水化物的化學(xué)式為
,C的元素符號(hào)為
,C在周期表中的位置為
.
(3)D元素的正三價(jià)離子的3d亞層為半充滿(mǎn),D的元素符號(hào)為
,其基態(tài)原子的電子排布式為
.
(4)E元素基態(tài)原子的M層全充滿(mǎn),N層沒(méi)有成對(duì)電子,只有一個(gè)未成對(duì)電子,E的元素符號(hào)為
,其基態(tài)原子的電子排布式為
.
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
某溫度下,在一容積固定的容器中,反應(yīng)aA(g)+bB(g)═hH(g)達(dá)到平衡后,A、B、H的物質(zhì)的量分別為a mol、b mol和h mol.已知a+b=2h,若保持溫度不變,將三者的物質(zhì)的量增大一倍,則下列判斷正確的是( )
| A、平衡不移動(dòng) |
| B、混合氣體的密度不變 |
| C、B的體積分?jǐn)?shù)增大 |
| D、a mol/L<c(A)<2a mol/L |
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
B、C、D、E均是短周期元素.B元素原子最外層上的電子數(shù)為內(nèi)層電子總數(shù)的2倍.B元素原子和C元素原子最外層電子數(shù)之差為2.C和D形成的化合物進(jìn)行焰色反應(yīng)火焰呈黃色.E元素的氣態(tài)單質(zhì)、E的最高價(jià)氧化物的水化物均能與D的最高價(jià)氧化物的水化物反應(yīng).
(1)上述4種元素按照原子序數(shù)由大到小排列為
、
、
、
;(填元素符號(hào));
(2)B、C形成的化合物(比空氣重)的結(jié)構(gòu)式為
;
(3)C、D的單質(zhì)在加熱條件下生成物質(zhì)X,其中含有化學(xué)鍵的類(lèi)型為
;X的電子式為
;
(4)Y是C的氣態(tài)氫化物.常溫下,將D的單質(zhì)投入Y中,發(fā)生反應(yīng)的離子方程式為
; 該反應(yīng)
(填“能”、“不能”)作為設(shè)計(jì)原電池的反應(yīng)原理.
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
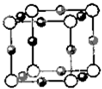
已知:A、B、C、D、E、F五種元素核電荷數(shù)依次增大,屬周期表中前四周期的元素.其中A原子核外有三個(gè)未成對(duì)電子;化合物B
2E的晶體為離子晶體,E原子核外的M層中只有兩對(duì)成對(duì)電子;C元素是地殼中含量最高的金屬元素;D單質(zhì)的熔點(diǎn)在同周期元素形成的單質(zhì)中是最高的;F原子核外最外層電子數(shù)與B相同,其余各層均充滿(mǎn).請(qǐng)根據(jù)以上信息,回答下列問(wèn)題:
(1)A、B、C、D的第一電離能由小到大的順序?yàn)?div id="p9vv5xb5" class='quizPutTag' contenteditable='true'>
(用元素符號(hào)表示);
(2)B的氯化物的熔點(diǎn)比D的氯化物的熔點(diǎn)
(填“高”或”低”),理由是
;
(3)E的最高價(jià)氧化物分子的空間構(gòu)型是
;
(4)F的核外電子排布式是
;
(5)A、F形成某種化合物的晶胞結(jié)構(gòu)如圖所示,則其化學(xué)式為
(黑色球表示F原子).
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
下列不需要用到二氧化硅的是( )
| A、光導(dǎo)纖維 | B、計(jì)算機(jī)芯片 |
| C、石英鐘表 | D、普通玻璃 |
|
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
下列有關(guān)描述中,與事實(shí)相符的是( )
| A、Al(OH)3、CaCO3都難溶,但溶解的部分都能完全電離 |
| B、復(fù)鹽是純凈物,而混鹽(如CaOCl2)是混合物 |
| C、弱電解質(zhì)溶液中有溶質(zhì)分子,但強(qiáng)電解質(zhì)溶液中難以存在溶質(zhì)分子 |
| D、電解質(zhì)溶液能夠?qū)щ姡且驗(yàn)橥娛闺娊赓|(zhì)電離產(chǎn)生了自由移動(dòng)的離子 |
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
為了確定一批合金廢料的成分并加以回收利用,某同學(xué)擬定了以下實(shí)驗(yàn)方案:
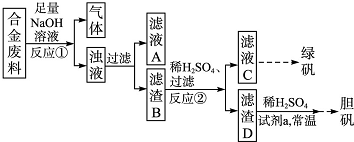
請(qǐng)回答下列問(wèn)題:
(1)從上述信息可確定該合金中一定含有Fe和
(填化學(xué)式).
(2)“試劑a”是一種不引入雜質(zhì)的綠色氧化劑,該氧化劑的化學(xué)式為
;濾渣D、稀硫酸和試劑a反應(yīng)的總化學(xué)方程式為
.
(3)若反應(yīng)①產(chǎn)生的氣體是H
2,則驗(yàn)證濾液A只含NaAlO
2不含Na
2SiO
3的方法是:取少量濾液A于試管中,
;如果濾液A只含Na
2SiO
3而不含NaAlO
2,則反應(yīng)①的離子方程式為
.
查看答案和解析>>
科目:高中化學(xué)
來(lái)源:
題型:
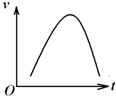
氯酸鉀和亞硫酸氫鈉發(fā)生氧化還原反應(yīng)生成Cl
-的速率v(縱坐標(biāo))與反應(yīng)時(shí)間t(橫坐標(biāo))的關(guān)系如圖所示,已知該反應(yīng)速率隨著溶液中c(H
+)的增大而加快.
(1)寫(xiě)出該反應(yīng)的離子方程式
.
(2)反應(yīng)開(kāi)始時(shí)反應(yīng)速率加快的原因是
.
(3)反應(yīng)后期反應(yīng)速率減慢的原因是
.
查看答案和解析>>



 課時(shí)訓(xùn)練江蘇人民出版社系列答案
課時(shí)訓(xùn)練江蘇人民出版社系列答案
 已知:A、B、C、D、E、F五種元素核電荷數(shù)依次增大,屬周期表中前四周期的元素.其中A原子核外有三個(gè)未成對(duì)電子;化合物B2E的晶體為離子晶體,E原子核外的M層中只有兩對(duì)成對(duì)電子;C元素是地殼中含量最高的金屬元素;D單質(zhì)的熔點(diǎn)在同周期元素形成的單質(zhì)中是最高的;F原子核外最外層電子數(shù)與B相同,其余各層均充滿(mǎn).請(qǐng)根據(jù)以上信息,回答下列問(wèn)題:
已知:A、B、C、D、E、F五種元素核電荷數(shù)依次增大,屬周期表中前四周期的元素.其中A原子核外有三個(gè)未成對(duì)電子;化合物B2E的晶體為離子晶體,E原子核外的M層中只有兩對(duì)成對(duì)電子;C元素是地殼中含量最高的金屬元素;D單質(zhì)的熔點(diǎn)在同周期元素形成的單質(zhì)中是最高的;F原子核外最外層電子數(shù)與B相同,其余各層均充滿(mǎn).請(qǐng)根據(jù)以上信息,回答下列問(wèn)題:
 氯酸鉀和亞硫酸氫鈉發(fā)生氧化還原反應(yīng)生成Cl-的速率v(縱坐標(biāo))與反應(yīng)時(shí)間t(橫坐標(biāo))的關(guān)系如圖所示,已知該反應(yīng)速率隨著溶液中c(H+)的增大而加快.
氯酸鉀和亞硫酸氫鈉發(fā)生氧化還原反應(yīng)生成Cl-的速率v(縱坐標(biāo))與反應(yīng)時(shí)間t(橫坐標(biāo))的關(guān)系如圖所示,已知該反應(yīng)速率隨著溶液中c(H+)的增大而加快.